摘要
对浅海中大量使用的Al-Zn-In-Mg-Ti牺牲阳极在深海低溶解氧环境下的性能进行了研究。通过恒电流法对Al-Zn-In-Mg-Ti牺牲阳极开路电位、工作电位、实际电容量、电流效率及溶解形貌等使役性能进行研究,并结合浸泡失重、动电位极化曲线、电化学阻抗谱、循环伏安等电化学方法以及SEM/EDS分析手段,探讨浅海现役Al-Zn-In-Mg-Ti牺牲阳极在深海低溶解氧环境下的电化学性能。结果表明:深海低溶解氧条件下,Al-Zn-In-Mg-Ti溶解速度减缓,活性元素的再沉积过程受到抑制,活化作用减弱,从而导致铝阳极表面氧化膜不易溶解,大量附着,造成其活化困难,放电性能下降,电流效率降低,阴极保护设计时需留出相应设计裕量。
关键词: 深海环境 ; 低溶解氧 ; 牺牲阳极 ; 电化学性能
在深海资源的勘探和开发过程中,其恶劣的腐蚀环境使各种金属构件面临着巨大的挑战,材料的保护问题亟待解决。与表层海水防护措施类似,深海环境中服役的材料一般采用阴极保护、涂层保护、耐蚀耐高压金属等方式进行腐蚀防护[1,2]。但由于深海环境下静水压力很高,材料及构件涂覆的常规有机涂层往往快速渗水而失去保护效力,因此采用牺牲阳极阴极保护法对深海环境下金属构件进行保护的研究受到越来越多的关注[3-7]。常用的牺牲阳极材料主要有铝基、镁基和锌基三大系列,而铝基牺牲阳极因比重小、电流效率高、发生电量大、对钢铁驱动电位适中、来源丰富、价格低廉等优点在海洋环境下钢铁的腐蚀防护中得到广泛的应用[8-10]。
目前,铝基牺牲阳极在浅海环境中已得到充分合理的使用,美国NACE和挪威DNV[11,12]都给出了相应的阴极保护设计标准。与浅海相比,深海环境中溶解氧、静水压力、温度、盐度、pH值、钙镁离子沉积和表面流速等因素都明显不同,有其独特的环境特性。上述环境因素与材料的腐蚀电化学行为密切相关,因此深海环境下牺牲阳极的性能可能与浅海环境下存在较大差异[13-16],铝基牺牲阳极在深海环境下是否能安全有效的使用值得关注。
Tawns等[15]研究了模拟2500 m深海环境下低碳钢采用牺牲阳极进行阴极保护的实验。结果表明,跟常压环境相比深海环境下牺牲阳极的消耗速率增大,阴极表面虽然也形成了较厚的钙质沉积层,但由于其保护能力变弱,深海下对低碳钢进行保护需要更大的阴极保护电流。Fischer等[16]认为牺牲阳极材料的性能与实验条件关系密切,研究显示5 MPa下Al-Zn-In阳极的工作电位比0.1 MPa下的正5~20 mV,而阳极电容量则低7%~10%。胡胜楠等[17]的研究表明,Al-Zn-In阳极在模拟深海环境下的溶解能力下降、放电量减少、电流效率降低,高静水压力加速了Al-Zn-In牺牲阳极晶界腐蚀,造成晶粒脱落,电流效率降低,含氧量降低、温度降低使得Al-Zn-In阳极发生钝化。Li等[18]研究了几种Al-Zn-In系牺牲阳极在低温下的性能,结果显示低温下A1-Zn-In-Cd阳极溶解不均匀,腐蚀产物不易脱落,性能变差;Al-Zn-In-Mg-Ti阳极在低温下则表现出较好的性能。本课题组研究结果显示[19],在模拟深海环境下 (高静水压+低温),Al-Zn-In-Mg-Ti牺牲阳极较浅海环境下腐蚀过程加速,放电量和电流效率减小,综合性能显著下降,然而上述研究没有考虑溶解氧的影响。
由于绝大多数金属在海水中的腐蚀行为都属于氧去极化腐蚀,溶解氧的含量会直接影响金属材料的腐蚀溶解行为。与空气充分接触的表层海水含氧量基本达到饱和状态,而随着海水深度增加,光照迅速减弱,由于光合作用产生的O2迅速减少,表层以下海水溶解氧随海水深度迅速降低,通常在500~1000 m达到最小值,深海具有低溶解氧的典型特征。因此,本课题以深海环境为背景,选取溶解氧含量作为独立研究变量,通过恒电流法对铝基牺牲阳极开路电位、工作电位、实际电容量、电流效率及溶解形貌等使役性能进行研究,并结合浸泡失重、动电位极化曲线、电化学阻抗谱 (EIS)、循环伏安等电化学方法以及扫描电子显微镜 (SEM) 和能谱仪 (EDS) 等分析手段,来探讨浅海现役Al-Zn-In-Mg-Ti牺牲阳极在深海低溶解氧环境下的电化学性能,旨在为深海环境下牺牲阳极的合理应用和相应的阴极保护设计提供理论指导与实验依据。
1 实验方法
1.1 样品准备
实验所用牺牲阳极材料为浅海现役Al-Zn-In-Mg-Ti牺牲阳极,所有样品均为原始浇铸状态,其化学成分 (质量分数,%) 为:Zn 4.82,In 0.02,Mg 0.88,Ti 0.05,Fe 0.05,Si<0.05,Cu<0.005,Al余量。实验采用99.9% (质量分数) 以上的商业纯铝、纯锌、纯铟以及铝镁合金、铝钛合金铸锭作为原料浇铸上述合金,具体浇铸工艺如下:根据设计好的阳极配方计算合金元素的用量,用万分之一的电子天平称取,放入试样袋中备用。将铝锭放入石墨坩埚中置于自动调温井式真空电阻炉,加热至780 °C以上,待铝锭完全融化后,迅速加入其他合金元素 (其中Mg和Ti以Al-Mg合金和Al-Ti合金的形式加入),用碳棒轻轻搅拌使其混合均匀,扒渣后于铸铁模具中浇铸成直径为40 mm,长70 mm的圆棒,自然冷却。
恒电流测试将铝合金牺牲阳极铸棒加工成直径为16 mm,长48 mm的圆柱形电极试样,并在一端加工出直径为3 mm,螺距5 mm的普通螺纹孔以便引出导线。
常规浸泡和电化学实验样品的尺寸为30 mm× 20 mm×3 mm,用水磨砂纸磨至2000#,经蒸馏水清洗、酒精除油、冷风吹干后放入干燥器中待用。其中,电化学样品与铜导线的接触部位用704硅橡胶涂封,待硅橡胶充分固化后放入干燥器中待用。
1.2 实验条件
作为牺牲阳极深海性能研究初探,本课题选择溶解氧为独立变量,分别在饱和溶解氧 (SDO) 和低溶解氧 (LDO) 条件下进行实验。其中,低溶解氧条件采用缓慢并持续通入高纯N2的方法对体系进行除氧,采用玻璃转子流量计控制N2流速为150~200 mL/min,经JPB-607A型便携式溶解氧分析仪测定,饱和溶解氧体系含氧量为6~7 mg/L,而低溶解氧体系含氧量为1~2 mg/L。其他参数则保持与浅海一致,温度均控制在 (25±1) °C。
实验溶液均采用人造海水,按ASTM标准D1141-98[20]配制而成,pH调至8.2。实验溶液由分析纯试剂和蒸馏水配制而成。
1.3 恒电流测试
采用CHI660E型电化学工作站,根据GB/T17848-1999标准[21]中的加速试验法对铝合金牺牲阳极的电化学性能进行测试。测试时间为96 h,对阳极施加恒定的电流,在0~24 h期间为1.5 mA/cm2,24~48 h为0.4 mA/cm2,48~72 h为4.0 mA/cm2,72~96 h为1.5 mA/cm2。辅助阴极采用碳钢钢筒,阴阳极工作面积比60∶1,参比电极为饱和甘汞电极 (SCE)。记录阳极的开路电位、加恒电流后的工作电位随时间的变化,观察阳极溶解形貌。实验结束后用浓硝酸清洗腐蚀产物,再用去离子水清洗、干燥、称重,根据失重计算实际电容量和电流效率。
1.4 常规电化学测试
常规电化学实验均采用CHI660E型电化学工作站进行测量,实验采用传统三电极体系,其中工作电极为所测样品,参比电极为饱和甘汞电极 (SCE),辅助电极为Pt电极。
待开路电位稳定后,进行动电位极化曲线的测试。测试起始电位为开路电位,扫描速率为0.33 mV·s-1,并采用自动补偿方法来补偿体系电阻的欧姆降。
待开路电位稳定后,进行循环伏安曲线测试。从开路电位向正方向扫+150 mV,然后回扫至开路电位,连续扫描3个循环,扫描速率为0.2 mV·s-1。
电化学阻抗谱测量是在开路电位下进行,频率范围为105~10-2 Hz,激励信号为5 mV,实验所得数据用ZSimpWin软件进行分析。
所有电化学实验需重复3次以上以保证结果的重现性。
1.5 表征分析
采用自带能谱仪 (EDS) 的INSPECT F50场发射扫描电子显微镜 (FE-SEM) 对Al-Zn-In-Mg-Ti牺牲阳极溶解形貌进行观察分析。
2 结果与讨论
2.1 Al-Zn-In-Mg-Ti牺牲阳极使役性能
恒电流法是评价牺牲阳极使役性能的常用方法,通过恒电流测试可以获得阳极开路电位OCP、工作电位CCP、实际电容量Q、电流效率η和表面溶解状况等结果。一个高性能的牺牲阳极应具有足够负且稳定的OCP和CCP、高的放电能力和η,并且表面溶解均匀,腐蚀产物疏松易脱落[22]。
两种溶解氧条件下Al-Zn-In-Mg-Ti牺牲阳极在人造海水中的开路电位测试结果如图1所示。可以看出,两种条件下,开路电位均随浸泡时间正移,但是正移幅度不大,约60 min后电位趋于稳定。有文献[17]表明,阳极表面在浸泡过程中有膜生长、钝化的过程,由此导致活化倾向减小,开路电位正移。由牺牲阳极表面溶解机理[23]分析可知,当牺牲阳极处在溶解初期,阳极基体表面逐渐形成一些氧化物膜层,这些氧化物膜相对于活性基体电位较正,所以致使阳极开路电位逐渐正移,而此时阳极表面上一些活性元素相对于氧化膜电位较负,形成局部阳极,可以优先溶解,此时会生成一些腐蚀性产物覆盖在阳极表面。随着这些腐蚀产物的形成与向溶液中扩散逐渐达到一个动态平衡,开路电位逐渐趋于稳定,最后保持基本不变。从图中可以看到,在两种条件下开路电位变化存在明显差别,在饱和氧条件下阳极的开路电位从约-1.143 V正移到-1.109 V,而在低溶解氧条件下阳极的开路电位从约-1.128 V正移到-1.055 V。对比可见,低溶解氧条件下牺牲阳极的开路电位比饱和氧条件下更正,说明低溶解氧条件下阳极表面形成了更多氧化物,使其更不易活化溶解。
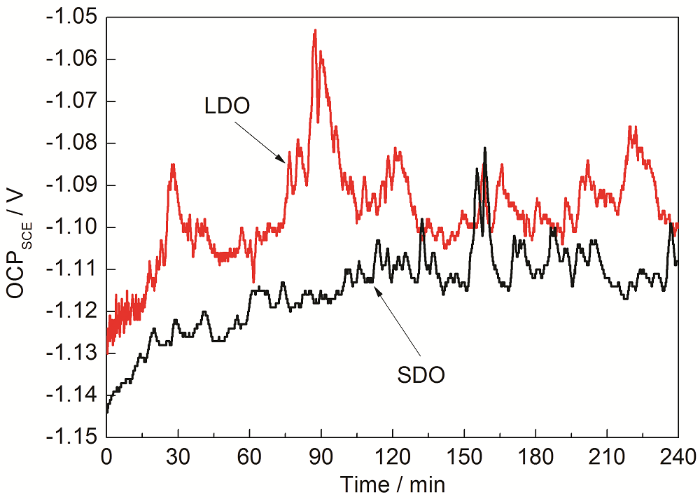
图1 Al-Zn-In-Mg-Ti牺牲阳极在两种溶解氧条件下的开路电位随时间的变化
图2是两种溶解氧含量下牺牲阳极恒电流极化下工作电位随时间的变化曲线。可以看出,每次更换电流参数后的工作电位都会迅速调整到新的稳定状态。参考NACE及DNV阴极保护准则[11,12],两种环境下牺牲阳极的CCP均落在钢的保护电位范围内,能够满足相应的阴极保护电位准则,表明Al-Zn-In-Mg-Ti牺牲阳极在深海低溶解氧环境中使用时仍能够起到保护作用。
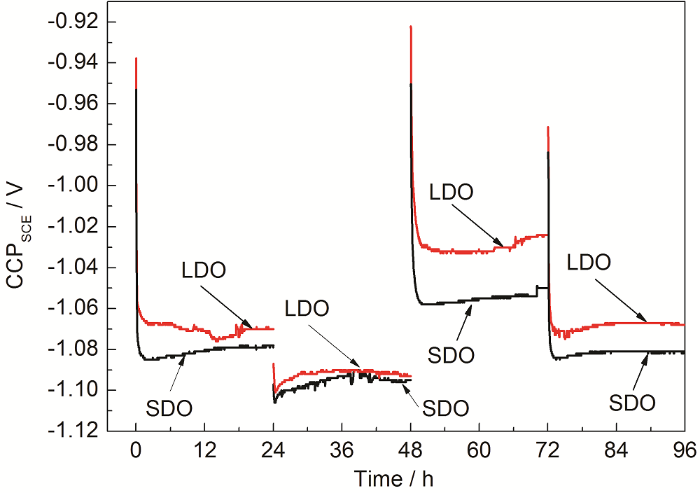
图2 Al-Zn-In-Mg-Ti牺牲阳极在两种溶解氧条件下工作电位随时间的变化
对比两种条件下工作电位的稳定值,可见在整个实验周期内低溶解氧条件下牺牲阳极的工作电位比在饱和氧条件下的正移;且极化电流密度越大,差别也越大。同样表明低溶解氧时Al-Zn-In-Mg-Ti牺牲阳极溶解阻力增大,活化放电能力下降。
对不同溶解氧含量下恒电流实验后牺牲阳极的实际电容量和电流效率进行计算,结果列于表1。可以看出,随着溶解氧含量的降低,铝合金牺牲阳极的实际电容量降低,电流效率也有所下降。这可能是由于其在深海低溶解氧环境下不易活化溶解,放电性能下降所造成的。
表1 Al-Zn-In-Mg-Ti牺牲阳极在两种溶解氧含量下的电化学性能
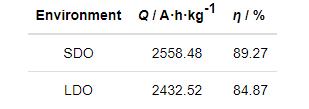
图3是Al-Zn-In-Mg-Ti牺牲阳极在两种溶解氧条件下恒电流测试后的宏观腐蚀形貌。可以看出,饱和氧条件下,牺牲阳极的溶解形貌更加均匀,腐蚀产物疏松易脱落;而低溶解氧条件下,阳极溶解欠均匀,且腐蚀产物有少量附着,这也验证了实际电容量和电流效率的计算结果。

图3 Al-Zn-In-Mg-Ti牺牲阳极在两种溶解氧条件下恒电流实验后宏观腐蚀形貌
对恒电流实验后去除腐蚀产物后的微观形貌 (见图4) 进行观察可见,两种条件下牺牲阳极均呈现晶界处优先溶解的特征,即均发生晶间腐蚀,表明溶解氧含量的降低并没有改变Al-Zn-In-Mg-Ti牺牲阳极的溶解形态和溶解机制。

图4 Al-Zn-In-Mg-Ti牺牲阳极在两种溶解氧条件下恒电流实验除锈后微观腐蚀形貌
综合上述结果,Al-Zn-In-Mg-Ti牺牲阳极在深海低溶解氧环境下使用时,其放电性能和电流效率均下降,阴极保护设计时需留出相应设计裕量。
2.2 Al-Zn-In-Mg-Ti合金的腐蚀溶解行为
2.2.1 腐蚀速率
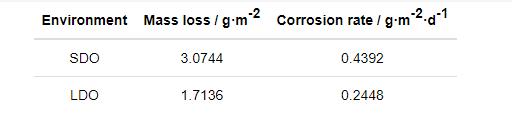
Al-Zn-In-Mg-Ti合金在两种溶解氧条件下人造海水中浸泡168 h后的腐蚀失重测试结果如表2所示。饱和溶解氧条件下其平均腐蚀速率为0.4392 g·m-2·d-1,而深海低溶解氧条件下为0.2448 g·m-2·d-1,比饱和氧条件下降低了44.26%。表明,在深海低溶解氧环境下Al-Zn-In-Mg-Ti合金的腐蚀速率显著下降。
表2 Al-Zn-In-Mg-Ti合金在两种溶解氧条件下浸泡168 h后的腐蚀失重测试结果
2.2.2 电化学性能研究
两种溶解氧含量下Al-Zn-In-Mg-Ti合金在人造海水中的动电位极化曲线如图5所示。可以看出,两种溶解氧含量下Al-Zn-In-Mg-Ti合金的极化曲线具有相似的特征,即阳极区均没有明显的钝化区域,表现为活化特征;而阴极过程均表现为氧扩散控制特征。根据铝合金牺牲阳极的腐蚀机理[23],In和Zn等元素具有活化作用,使阳极表面发生活化元素的“溶解-再沉积”过程,因此阳极表面不会形成完整的钝化膜。由于人造海水pH为8.2呈弱碱性,所以O2成为主要去极化剂,O的扩散为阴极过程控制步骤。两种条件下自腐蚀电位差别不大,低氧下的结果略高。相同极化电位下,低溶解氧条件下的铝阳极的阴、阳极电流密度均低于饱和溶解氧下的结果,其中低氧条件下的阴极极限扩散电流密度比饱和氧条件下的低约一个数量级,表明溶解氧含量的降低使得Al-Zn-In-Mg-Ti合金的阳极活性溶解和阴极氧扩散过程均有所减缓,总的腐蚀溶解速率大幅下降。
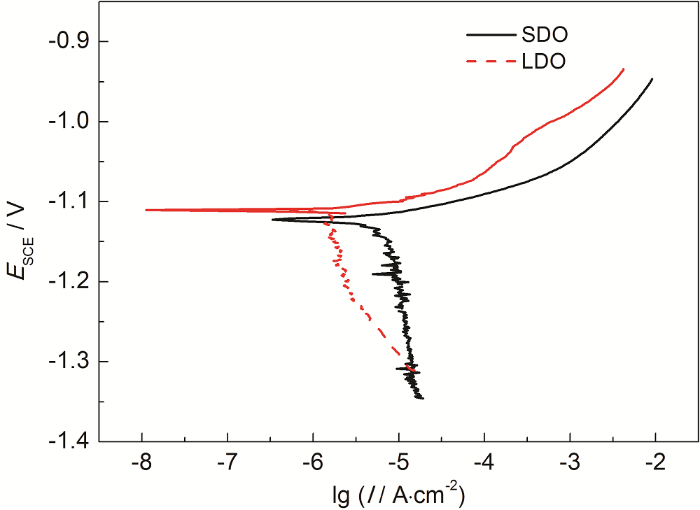
图5 Al-Zn-In-Mg-Ti合金在两种溶解氧含量下动电位极化曲线
Al-Zn-In-Mg-Ti合金在两种溶解氧含量的人造海水中的循环伏安曲线如图6所示。可以看出,两种条件下,初始扫描阶段曲线都存在一个平台区,此时电流不随电位的正移而改变,表明此时样品表面氧化膜还未遭到破坏。随着电位继续正移,氧化膜溶解破坏,对应的活化电流增加。达到峰值后电位回扫,如此往复3次,合金在不断的氧化还原的过程中逐步活化。对比两种条件下循环伏安曲线的特征,可见低溶解氧条件下初始平台区更长,即合金氧化膜发生溶解需要的时间更长;同时,低溶解氧条件下合金氧化膜溶解破坏后的整个氧化还原过程中其活化电流始终保持较低,极化阻力更大,说明低溶解氧条件下铝合金难以活化,放电性能显著低于饱和氧条件。
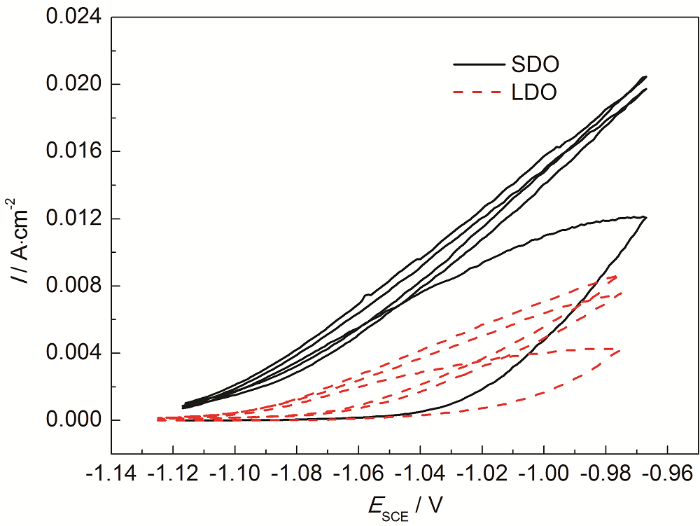
图6 Al-Zn-In-Mg-Ti合金在两种溶解氧条件下循环伏安曲线
为了进一步探究深海低溶解氧环境下Al-Zn-In-Mg-Ti合金的腐蚀溶解历程,进行了EIS测试,相应的Nyquist结果如图7所示。可以看出,两种条件下的Nyquist图谱具有不同的特征,饱和溶解氧条件下的Nyquist图谱由一个高频容抗弧和一个明显的低频感抗弧组成,而低溶解氧时Nyquist图谱仅由一个容抗弧组成。
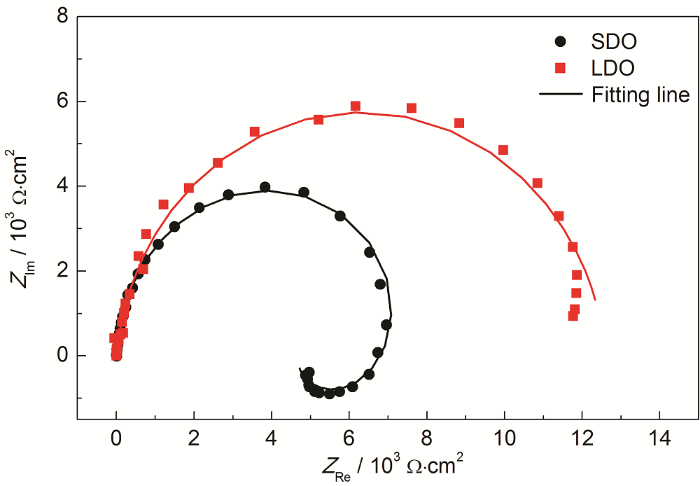
图7 Al-Zn-In-Mg-Ti合金在两种溶解氧条件下的Nyquist谱
研究[19,24]表明,高频容抗弧来自于基体金属在电解质中的电荷转移电阻和界面双电层电容的贡献,容抗弧的半径越大,则表示阳极溶解的反应阻力越大,溶解速率越低,不易活化。从图7可以看出,低溶解氧条件下铝合金的容抗弧直径明显比饱和溶解氧时的要大,说明低溶解氧下,铝合金的电荷转移电阻增大,反应受阻滞程度大,活性溶解明显减慢。
一般认为[24-26],低频感抗弧的出现与Al-Zn-In-Mg-Ti合金的点蚀 (此处为活性点的优先溶解) 诱导过程或特定离子的吸附过程有关。赵国强等[25]研究显示,当工作电流足够大时,Al-Zn-In阳极表面氧化膜逐渐破裂溶解,Nyquist图由中高频容抗弧和低频感抗弧组成;而在工作电流密度较小的情况下,Al-Zn-In阳极活化受阻,表面形成了一层氧化膜,Nyquist图没有出现低频感抗弧。黄燕滨等[26]研究认为,自腐蚀的牺牲阳极初期Nyquist图有低频感抗弧,190 h时感抗弧消失,而偶接的牺牲阳极Nyquist图上在不同时间始终存在感抗弧,认为这是由于偶接的牺牲阳极表面始终随机分布活性溶解点,腐蚀溶解反应一直进行,没有出现真正的闭塞蚀孔。本实验中,根据图7所示EIS测试结果,饱和溶解氧条件下在Nyquist图低频段还观察到了感抗弧,表明该条件下铝合金表面持续活化,没有完整的氧化膜,而低溶解氧条件下则没有出现感抗,可能是由于活化过程受阻,腐蚀产物膜在阳极表面堆积所致。
因此,使用图8所示的等效电路进行拟合,其中:Rs代表溶液电阻,Qdl为双电层电容,Rt为电荷转移电阻,R1和L为反映点蚀行为的相应参数。拟合结果如图7中实线所示,可以看出拟合结果与实验数据吻合的较好。根据此等效电路拟合得到相应的模型参数值见表3,其中参数χ2反映拟合结果的精确度。表4所示的结果显示χ2的值都很小,再一次验证拟合结果与实验数据吻合较好。
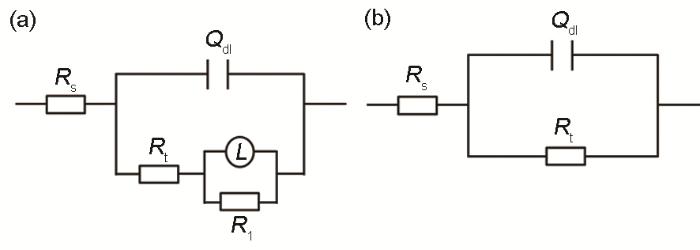
图8 EIS数据对应的等效电路图
表3 Al-Zn-In-Mg-Ti合金在两种溶解氧条件下EIS数据的拟合结果
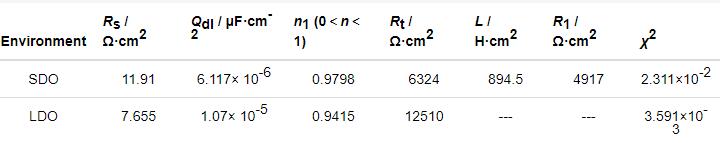
Rt反映电化学反应信息的Faraday过程,因此它可以代表电化学反应速度。表3显示,低溶解氧条件下Al-Zn-In-Mg-Ti合金的Rt约为饱和条件下的两倍,表明降低溶解氧可显著抑制铝合金的电荷转移过程,使得其活化过程受阻。
2.2.3 腐蚀形貌
图9是Al-Zn-In-Mg-Ti合金在两种溶解氧条件下浸泡168 h后的宏观腐蚀形貌。可以看出,两种条件下材料表面都均匀散布着局部腐蚀坑,低溶解氧条件下阳极表面锈蚀颜色较饱和溶解氧下的更浅,表明其腐蚀程度较轻。溶解氧含量的降低,使得Al-Zn-In-Mg-Ti合金腐蚀程度减轻,与腐蚀速率计算结果相符。另外从宏观形貌图中可见,低溶解氧条件下材料表面呈现白色腐蚀产物的附着,对其进行微观形貌观察,结果见图10。可以看出,饱和溶解氧条件下样品表面有明显的局部腐蚀溶解,产物疏松附着较少;而低溶解氧条件下样品表面腐蚀产物较为致密,大量附着在基体表面。而腐蚀产物的附着会抑制Al-Zn-In-Mg-Ti合金的进一步活化溶解,不利于其牺牲阳极放电性能的发挥,这也验证了上述EIS分析结果。

图9 Al-Zn-In-Mg-Ti合金在两种溶解氧条件下浸泡168 h后宏观腐蚀形貌

图10 Al-Zn-In-Mg-Ti合金在两种溶解氧条件下浸泡168 h后微观腐蚀形貌
进一步的EDS结果 (见图11) 显示,在两种条件下Al-Zn-In-Mg-Ti合金在人造海水中的腐蚀产物,主要成分均为Al,Mg和Zn的氧化物 (In含量较少,不易检测到)。对比可见,低溶解氧条件下产物膜Mg含量明显更高,而饱和氧条件下Zn含量则更高,表明溶解氧的降低改变了合金的活化溶解历程,从而改变了其产物膜的成分和附着状态。
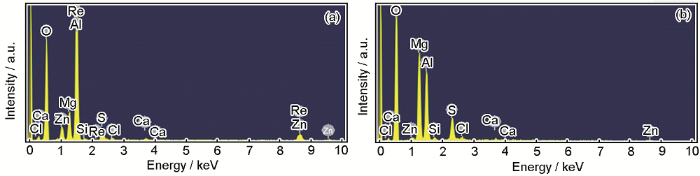
图11 Al-Zn-In-Mg-Ti合金在两种溶解氧条件下浸泡168 h后表面EDS结果
2.3 溶解氧对阳极性能的影响机制
为了阐明Al-Zn-In-Mg-Ti阳极在低溶解氧下放电性能和电流效率有所降低这一现象发生的原因,从阳极的活化溶解过程入手进行分析,探讨溶解氧对阳极性能的影响机制。根据Reboul等[23]关于铝阳极的溶解-再沉积机理,阳极的活化溶解分为三步:
第一步:对于本研究中的阳极材料,由于富Mg、In及富Fe、Si等偏析相的存在[19],造成了阳极表面氧化膜电位不均匀,形成了表面的微区电位差,溶解首先从这些区域开始,因此偏析相的存在为Al合金阳极提供最初的活化源,材料开始溶解。
第二步:Al及铝固溶体中的合金元素溶解下来,在溶液中氧化生成阳离子 (M=Zn,Mg,In):Al(M)→Al3++Mn+。O2作为本实验体系中主要去极化剂,其含量直接影响阳极溶解反应速率,因此当溶解氧含量降低时,氧化膜溶解破裂受阻,生成的合金元素阳离子浓度降低。
第三步:上一步生成的合金元素阳极离子由于其电极电位比Al正,因而获得基体Al上的电子发生交换反应:3Mn++nAl→nAl3++3M,进而再沉积到Al表面。再沉积的合金元素,分布在氧化膜和基体之间,对二者有机械分割作用,使得铝氧化膜局部溶解破裂,合金电位负移,Al溶解得以继续进行。根据文献[23,27],铝阳极中起活化作用的元素通常有Zn,In,Hg,Sn和Ga等,活化离子的沉积速度受活化离子浓度及其还原电位影响。饱和氧条件下,生成的活性合金离子 (此处为Zn2+和In3+) 的再沉积使得铝阳极不断活化溶解,因此经过168 h后其表面产物疏松附着较少 (见图10),且产物中Zn含量较高 (见图11) (可能由于合金中In含量太少,没有检测到In的沉积);而低溶解氧条件下,由于生成的活性合金离子 (Zn2+和In3+) 浓度较低,其再沉积速度变慢,活化作用减弱,从而导致铝阳极表面氧化膜不易溶解,基体放电性能下降,经过168 h后表面产物较为致密并大量附着 (见图10),生成了更多Mg的氧化物 (见图11)。
除了放电性能,电流效率也是评价牺牲阳极实用价值的重要参数。铝阳极电流效率损失通常归纳为自腐蚀、第二相的脱落和晶粒的脱落3个原因。齐公台等[28]认为,铝阳极表面阴极相的存在导致阳极的微电池自腐蚀,使阳极的电流效率受到损失,而阳极表面氧化膜相对于基体电位更正,可以充当微电池的阴极相,使基体发生自腐蚀,从而抢走了本应供给被保护金属的有效电流,造成电流效率的损失。根据赵国强等[25]的研究,当Al-Zn-In阳极表面大部分区域形成氧化膜时,阳极表面过程变为氧化膜的形成和溶解的动态平衡以及局部裸露金属的腐蚀,氧化膜可能发生化学溶解或机械破损而不会向外发射电流,从而造成阳极的质量损耗,使电流效率降低。因此,低溶解氧条件下阳极表面产物膜的大量附着,一方面显著降低了阳极的放电性能,同时也是造成电流效率下降的主要原因。
3 结论
(1) 与浅海环境相比,在深海低溶解氧条件下Al-Zn-In-Mg-Ti牺牲阳极的开路电位和工作电位皆升高,而实际电容量和电流效率均下降,溶解欠均匀,阴极保护设计时需留出相应设计裕量。
(2) 在深海低溶解氧条件下,Al-Zn-In-Mg-Ti溶解速率降低,阳极活性溶解和阴极氧扩散过程均有所减缓,活化过程受到抑制。低溶解氧条件下铝阳极表面氧化膜大量附着且更加致密,阻碍了其进一步的活化。
(3) 溶解氧含量的降低使得铝阳极表面生成的活性合金离子浓度较低,其再沉积过程受到抑制,活化作用减弱,从而导致铝阳极表面氧化膜不易溶解,大量附着,造成其活化困难,放电性能下降,电流效率降低。
参考文献
[1] Schumacher M. Sea Water Corrosion Handbook [M]. New Jersey: Noye Data, 1979
[2] Traverso P, Canepa E. A review of studies on corrosion of metals and alloys in deep-sea environment [J]. Ocean Eng., 2014, 87: 10
doi: 10.1016/j.oceaneng.2014.05.003
[3] Zhou J L, Li X G, Cheng X Q, et al. Research progress on corrosion of metallic materials in deep sea environment [J]. Corros. Sci. Prot. Technol., 2010, 22: 47
[3] (周建龙, 李晓刚, 程学群等. 深海环境下金属及合金材料腐蚀研究进展 [J]. 腐蚀科学与防护技术, 2010, 22: 47)
[4] Tang J W, Shao Y W, Zhang T, et al. Effect of cyclic pressure on degradation behavior of epoxy coating in simulated deep ocean environment [J]. J. Chin. Soc. Corros. Prot., 2011, 31: 275
[4] (唐俊文, 邵亚薇, 张涛等. 循环压力对环氧涂层在模拟深海环境中失效行为的影响 [J]. 中国腐蚀与防护学报, 2011, 31: 275)
[5] Sun H J, Liu L, Li Y, et al. Effect of hydrostatic pressure on the corrosion behavior of a low alloy steel [J]. J. Electrochem. Soc., 2013, 160: C89
[6] Liu L, Cui Y, Li Y, et al. Failure behavior of nano-SiO2 fillers epoxy coating under hydrostatic pressure [J]. Electrochim. Acta, 2012, 62: 42
doi: 10.1016/j.electacta.2011.11.067
[7] Rhee K Y, Lee S M, Park S J. Effect of hydrostatic pressure on the mechanical behavior of seawater-absorbed carbon/epoxy composite [J]. Mater. Sci. Eng., 2004, A384: 308
[8] Idusuyi N, Oluwole O O. Aluminium anode activation research-a review [J]. Int. J. Sci. Technol., 2012, 2: 12
[9] Zhang W Y, Wang X Y, Xi L J, et al. Research progress of sacrificial anode materials in cathodic protection technology [J]. Corros. Sci. Prot. Technol., 2013, 25: 420
[9] (张万友, 王鑫焱, 郗丽娟等. 阴极保护技术中牺牲阳极材料的研究进展 [J]. 腐蚀科学与防护技术, 2013, 25: 420)
[10] Sun M X, Ma L, Zhang H B, et al. Research progress in aluminum alloy sacrificial anode materials [J]. Equip. Environ. Eng., 2018, 15(3): 9
[10] (孙明先, 马力, 张海兵等. 铝合金牺牲阳极材料的研究进展 [J]. 装备环境工程, 2018, 15(3): 9)
[11] NACE Standard RP0176-2003, Item No. 21018, Standard Recommended Practice in Corrosion Control of Steel Fixed Offshore Structures Associated with Petroleum Production [S]. Houston, 2003
[12] Det Norske Veritas. DNV-RP-B401 Cathodic Protection Design, Recommended Practice [S]. Norway: Det Norske Veritas, 2005
[13] Li C J, Du M. Research and development of cathodic protection for steels in deep seawater [J]. J. Chin. Soc. Corros. Prot., 2013, 33: 10
[13] (李成杰, 杜敏. 深海钢铁材料的阴极保护技术研究及发展 [J]. 中国腐蚀与防护学报, 2013, 33: 10)
[14] Canepa E, Stifanese R, Merotto L, et al. Corrosion behaviour of aluminium alloys in deep-sea environment: A review and the KM3NeT test results [J]. Mar. Struct., 2018, 59: 271
doi: 10.1016/j.marstruc.2018.02.006
[15] Tawns A, Oakley R. Cathodic protection at simulated depth of 2500 m [A]. Corrosion 2000 [C]. Orlando, Florida, 2000
[16] Fischer K P, Espelid B, Schei B. A review of CP current demand and anode performance for deep water [A]. Corrosion 2001 [C]. Houston, Texas, 2001
[17] Hu S N. Research on property of Al-Zn-In sacrifical anode under simualte deep sea water [D]. Harbin: Harbin Engineering University, 2012
[17] (胡胜楠. 模拟深海环境下Al-Zn-In牺牲阳极性能研究 [D]. 哈尔滨: 哈尔滨工程大学, 2012)
[18] Li W L, Yan Y G, Chen G, et al. The effect of temperature and dissolved oxygen concentration on the electrochemical behavior of Al-Zn-Inbased anodes [J]. Proced. Eng., 2011, 12: 27
doi: 10.1016/j.proeng.2011.05.006
[19] Sun H J, Liu L, Li Y, et al. The performance of Al-Zn-In-Mg-Ti sacrificial anode in simulated deep water environment [J]. Corros. Sci., 2013, 77: 77
doi: 10.1016/j.corsci.2013.07.029
[20] ASTM. ASTM D1141-98 Standard practice for the preparation of substitute ocean water [S]. West Conshohocken, PA: ASTM International, 2008
[21] State Bureau of Quality and Technical Supervision. GB/T17848-1999 Test methods for electrochemical properties of sacrificial anodes [S]. Beijing: China Standard Press, 2000
[21] (国家质量技术监督局. GB/T17848-1999 牺牲阳极电化学性能试验方法 [S]. 北京: 中国标准出版社, 2000)
[22] Hu S X. Handbook of Cathodic Protection Engineering [M]. Beijing: Chemical Industry Press, 1999
[22] (胡士信. 阴极保护工程手册 [M]. 北京: 化学工业出版社, 1999)
[23] Reboul M C, Gimenez P H, Rameau J J. A proposed activation mechanism for Al anodes [J]. Corrosion, 1984, 40: 366
doi: 10.5006/1.3593939
[24] Ma J L, Wen J B, Li G X, et al. The corrosion behaviour of Al-Zn-In-Mg-Ti alloy in NaCl solution [J]. Corros. Sci., 2010, 52: 534
doi: 10.1016/j.corsci.2009.10.010
[25] Zhao G Q, Wei Y H, Li J. Current efficiency and corrosion mechanism of Al-Zn-In sacrificial anode at different current densities [J]. J. Chin. Soc. Corros. Prot., 2015, 35: 69
[25] (赵国强, 魏英华, 李京. Al-Zn-In牺牲阳极在不同工作电流密度下电流效率及溶解机制的研究 [J]. 中国腐蚀与防护学报, 2015, 35: 69)
doi: 10.11902/1005.4537.2013.279
[26] Huang Y B, Song G W, Liu X B, et al. Corrosion protection of Al-Zn-In-Mg-Ga-Mn aluminous sacrificial anode [J]. J. Chin. Soc. Corros. Prot., 2012, 32: 44
[26] (黄燕滨, 宋高伟, 刘学斌等. Al-Zn-In-Mg-Ga-Mn腐蚀防护行为研究 [J]. 中国腐蚀与防护学报, 2012, 32: 44)
[27] Xu H Y, Li Y B. Activation behavior of aluminum sacrificial anodes in sea water [J]. J. Chin. Soc. Corros. Prot., 2008, 28: 186
[27] (徐宏妍, 李延斌. 铝基牺牲阳极在海水中的活化行为 [J]. 中国腐蚀与防护学报, 2008, 28: 186)
[28] Qi G T, Qu J E, Liao H X. Study on the electrochemical performances of segregation phases in alumium anodes containing RE [J]. J. Chin. Soc. Corros. Prot., 2003, 23: 355
[28] (齐公台, 屈钧娥, 廖海星. 含RE铝阳极中析出相的电化学行为研究 [J]. 中国腐蚀与防护学报, 2003, 23: 355)
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





