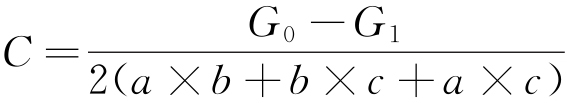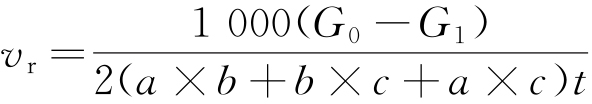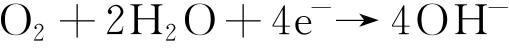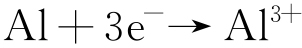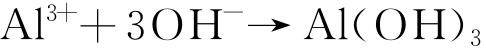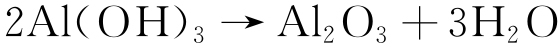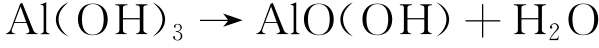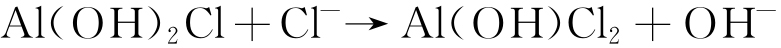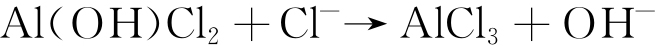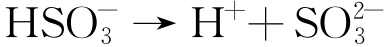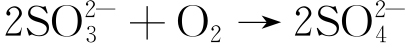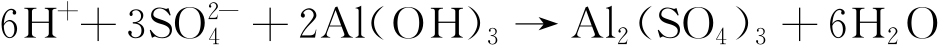| 元素 | Fe | Si | Cu | Mn | Zn | Mg | Al |
|---|---|---|---|---|---|---|---|
| 质量分数/% | 0.35 | 0.25 | 0.05 | 0.03 | 0.05 | 0.03 | 余量 |
铝及其合金由于优异的耐蚀性、良好的力学性能、质量轻等特点,常用于建筑、电气工程和交通运输,其中60%~70%的合金是直接在大气环境中使用的[1-3]。由于铝及其合金表面会生成保护性氧化膜,因此具有良好的耐蚀性。铝及其合金的耐蚀性可以满足一般大气环境中的使用要求,但是在海洋大气等严酷的使用环境中会出现严重的腐蚀问题。人们普遍认为,在海洋大气中高的相对湿度和氯化物沉积速率会增加金属材料的腐蚀速率[4-6]。海洋大气环境中的Cl-具有很强的侵蚀性,可以吸附在金属表面破坏保护性氧化膜,导致铝合金的快速腐蚀[7-8]。
随着现代工业的快速发展,沿海城市的大气环境除具有典型的高湿度、高盐分(Cl-)特点外,工业生产中大气污染物SO2的含量也逐年增多,海洋大气环境受到污染[9],导致金属材料表面形成酸性的薄液膜,进而加速腐蚀的发生[10-11]。
笔者通过电化学测试、周期浸润加速试验,研究了A1060纯Al在3.5%(质量分数,下同)NaCl溶液和3.5% NaCl+0.02 mol/L NaHSO3溶液中的腐蚀行为,揭示了A1060纯Al在污染海洋大气环境中的腐蚀机理,以期为污染海洋大气环境中铝及其合金的选用提供参考。
1. 试验
1.1 试验材料
试验材料为A1060纯Al(简称纯Al),其化学成分如表1所示。
1.2 周期浸润加速腐蚀试验
周期浸润加速腐蚀试验参照国标GB/T 19746-2005《金属和合金的腐蚀盐溶液周浸试验》执行,仪器选用北京科技大学自行设计的周期腐蚀加速实验箱,试验溶液分别为3.5%(质量分数)NaCl溶液(模拟海洋大气环境),以及由3.5% NaCl和0.02 mol/L NaHSO3配制而成的溶液(模拟污染海洋大气环境)。试样尺寸为50 mm×25 mm×2.5 mm,试验前采用水磨砂纸逐级打磨试样表面,然后用去离子水和酒精冲洗,冷风吹干后放入真空干燥箱中备用。周期浸润加速腐蚀试验以60 min为一个循环周期,每个循环包括15 min浸入和45 min干燥。周期浸润加速腐蚀试验水浴箱温度为(40±2)℃,取样周期分别为24,48,96,192,360,720 h。
试验后,需清除试样表面腐蚀产物,过程如下:首先,将50 mL磷酸、20 g三氧化铬和蒸馏水配制成1 000 mL清洗溶液,清洗试样表面;然后,在质量浓度为1.42 g/mL的浓硝酸中放置5 min以去除表面腐蚀产物;最后,用清水冲洗试样并在酒精溶液中浸泡,取出后立即用冷风吹干,放入干燥器中保存并称量。
采用FEI Quanta-250型扫描电子显微镜(SEM)对试样进行表面形貌观察;采用ESCALAB 250Xi型X射线光电子能谱(XPS)对试样进行物相分析。
1.3 电化学测试
电化学测试采用三电极体系,在VMP3多通道电化学工作站上进行,其中纯Al试样为工作电极,铂片为辅助电极,饱和甘汞电极(SCE)为参比电极,测试溶液分别为3.5% NaCl溶液和3.5% NaCl+0.02 mol/L NaHSO3溶液。工作电极是尺寸为10 mm×10 mm×3 mm的块状试样,通过环氧树脂进行密封并保留1 cm2工作面积。测试前,用240~2 000号SiC砂纸逐级打磨封好的试样后,用乙醇和去离子水清洗待用。电化学阻抗谱(EIS)的频率扫描范围为10 mHz~100 kHz,交流正弦波扰动幅值为10 mV。极化曲线测试采用动电位扫描的方法,扫描速率为0.167 mV/s。电化学测量至少重复3次,以确保结果的可重复性。
2. 结果与讨论
2.1 电化学性能
由图1可见,纯Al在3.5% NaCl+0.02 mol/L NaHSO3溶液中的自腐蚀电位(Ecorr)明显低于在3.5% NaCl溶液中。根据Tafel外推法对动电位极化曲线进行分析,结果表明,纯Al在3.5% NaCl+0.02 mol/L NaHSO3溶液中的自腐蚀电位和腐蚀电流密度分别为-911 mV和1.01 μA/cm2,而纯Al在3.5% NaCl溶液中的自腐蚀电位和腐蚀电流密度分别为-864 mV和0.30 μA/cm2。这说明纯Al在3.5% NaCl+0.02 mol/L NaHSO3溶液中的腐蚀速率和腐蚀倾向均高于在3.5% NaCl溶液中。
EIS可用来反映电解质溶液和试样之间界面处的电化学响应信息。通常,半圆弧直径越大表明材料的耐蚀性越好。由图2(a)可见,纯Al在3.5% NaCl溶液中的Nyquist曲线半圆弧直径较大,这表明其具有更好的耐蚀性。Bode图低频(0.01 Hz)阻抗模值(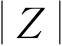 )可以用作金属阻隔性能的半定量指标。由图2(b)可见,Al在3.5% NaCl和3.5% NaCl+0.02 mol/L NaHSO3溶液中的低频阻抗模值分别为37 032Ω·cm2和19 800Ω·cm2。以上结果表明,纯Al在3.5% NaCl+0.02 mol/L NaHSO3溶液中的耐蚀性远低于在3.5% NaCl溶液中。
)可以用作金属阻隔性能的半定量指标。由图2(b)可见,Al在3.5% NaCl和3.5% NaCl+0.02 mol/L NaHSO3溶液中的低频阻抗模值分别为37 032Ω·cm2和19 800Ω·cm2。以上结果表明,纯Al在3.5% NaCl+0.02 mol/L NaHSO3溶液中的耐蚀性远低于在3.5% NaCl溶液中。
2.2 宏观形貌
由图3可见:在3.5% NaCl溶液中,纯Al经192 h周期浸润试验后,表面没有出现明显的腐蚀现象;经320 h周期浸润试验后,试样表面出现腐蚀产物并产生点蚀特征;而在3.5% NaCl+0.02 mol/L NaHSO3溶液中,纯Al经24 h周期浸润试验后,表面开始出现少量腐蚀产物,随着周期浸润时间的延长,表面腐蚀产物越来越多;在周期浸润时间到达96 h后,表面已经被大量白色的麻点覆盖,之后麻点开始出现聚集变大。以上结果表明,在模拟污染海洋大气环境中,纯Al会较早出现腐蚀问题且腐蚀更严重。
2.3 微观形貌
由图4可见:在3.5% NaCl溶液中,纯Al经24 h周期浸润试验后,表面没有明显的腐蚀产物出现,存在打磨过程出现的磨痕;经720 h周期浸润试验后,纯Al表面被腐蚀产物覆盖。然而,在3.5% NaCl+0.02 mol/L NaHSO3溶液中,纯Al经24 h周期期浸润试验后,表面完全被腐蚀产物所覆盖,原本表面的磨痕也已经完全被遮盖;经过720 h周期浸润后,纯Al表面的腐蚀更加严重。
由图5可见:在3.5% NaCl溶液中,纯Al经24 h周期浸润试验后,表面有些许小蚀坑出现;随着周期浸润时间延长至720 h,腐蚀坑的数量明显增加,并且有些蚀坑开始连成一片;在3.5% NaCl+0.02 mol/L NaHSO3溶液中,纯Al经24 h周期浸润试验后,表面出现大量的点蚀坑,且点蚀坑已经出现了聚集;当周期浸润时间延长至720 h时,试样表面出现大量腐蚀坑,且腐蚀向金属深处发展。
2.4 腐蚀动力学
根据标准规定的腐蚀结果评估方法,对经周期浸润腐蚀试验后的纯Al试样进行除锈,然后按式(1)进行腐蚀质量损失量计算。
|
|
(1) |
式中:C为单位面积腐蚀质量损失量,g/m2;G0为原始试样的质量,g;G1为周期浸润腐蚀试验后试样的质量,g;a、b、c分别为试样长度、宽度和厚度,m。
由图6可知:在相同的周期浸润时间下,纯Al在3.5% NaCl+0.02 mol/L NaHSO3溶液中的质量损失量远大于在3.5% NaCl溶液中;当周期浸润试验时间为720 h时,纯Al在3.5% NaCl和3.5% NaCl+0.02 mol/L NaHSO3溶液中的质量损失量分别为2.35 g/m2和9.70 g/m2。该结果表明,模拟污染海洋大气环境对纯Al具有更严重的腐蚀破环性。
利用幂函数C=Atn对周期浸润加速腐蚀质量损失结果进行拟合,如图6中虚线所示。其中,A为初期大气腐蚀参数,n为长期大气腐蚀趋势[12-14]。n>1表示腐蚀加速过程,n<1表示腐蚀减速过程[12]。根据图6插图中n的拟合结果可知,纯Al在3.5% NaCl+0.02 mol/L NaHSO3溶液中的腐蚀更严重。
根据式(2)计算周期浸润加速试验后纯Al试样的腐蚀速率。
|
|
(2) |
式中:vr表示腐蚀速率,μm/a;ρ为钢密度,取值为7.8 g/cm3;A为试样的表面积,μm2;t为周期浸润试验时间,h。
由图7可见:在整个腐蚀过程中,纯Al在3.5% NaCl+0.02 mol/L NaHSO3模拟溶液中的腐蚀速率始终高于在3.5% NaCl溶液中;在腐蚀后期,纯Al在3.5% NaCl溶液和3.5% NaCl+0.02 mol/L NaHSO3模拟溶液中的腐蚀速率分别为0.008 μm/a和0.031 μm/a。
2.5 讨论
阴极反应主要为氧还原反应,见式(3)。
|
|
(3) |
阳极反应见式(4)。
|
|
(4) |
由于阴极反应,局部pH升高,因此形成式(5)所示反应。
|
|
(5) |
Al(OH)3最终转变成Al2O3和AlO(OH)[17],见式(6)~(7)。
|
|
(6) |
|
|
(7) |
而在海洋大气环境中,由于Cl-在铝及其合金表面沉积,Cl-会通过竞争吸附而逐渐取代表面生成的Al(OH)3中的OH-,生成AlCl3,具体反应过程见式(8)~(10)[16]。
|
|
(8) |
|
|
(9) |
|
|
(10) |
因此,铝及其合金在海洋大气环境中的腐蚀产物主要为Al(OH)3、Al2O3、AlO(OH)和AlCl3等。
随着现代工业的快速发展,沿海城市的大气环境除具有典型的高湿度、高盐分(Cl-)的海洋大气特点外,由于工业生产,大气污染物SO2的含量也在逐渐增多,导致工业海洋大气环境的出现。工业大气中的SO2可氧化形成酸雨,也能溶入薄液膜中通过一系列的反应生成H+和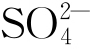 ,这会导致薄液膜的酸性和导电性均增加,促进腐蚀反应的发生。实验室中通常采用3.5% NaCl+0.02 mol/L NaHSO3溶液进行周期浸润加速腐蚀试验,以研究污染海洋大气的腐蚀性[18]。
,这会导致薄液膜的酸性和导电性均增加,促进腐蚀反应的发生。实验室中通常采用3.5% NaCl+0.02 mol/L NaHSO3溶液进行周期浸润加速腐蚀试验,以研究污染海洋大气的腐蚀性[18]。
由图8可见,纯Al在3.5% NaCl+0.02 mol/L NaHSO3溶液中经720 h周期浸润试验后,表面腐蚀产物中主要含有Al、O、Cl和S等四种元素。为了进一步确定腐蚀产物的物相,对Al 2p的高分辨XPS结果进行了分析,如图9所示。结果表明,Al 2p谱图中74.0 eV、74.9 eV、75.5 eV和76.7 eV四个峰分别对应Al2O3、Al2(SO4)3、AlCl3和AlO(OH)四种物相[19-22]。综上可见,纯Al在3.5% NaCl+0.02 mol/L NaHSO3溶液中经720 h周期浸润试验后,表面腐蚀产物物相主要有Al2O3、Al2(SO4)3、AlCl3和AlO(OH)。Al2(SO4)3是侵蚀性离子HSO3-作用的结果,具体的反应见式(11)~(13)[3,23-24]。
|
|
(11) |
|
|
(12) |
|
|
(13) |
Al2(SO4)3结构疏松,比Al2O3、Al(OH)3和AlO(OH)等氧化物更容易脱落,试样失去原本氧化物对表面物质交换的屏蔽作用,出现严重的腐蚀。结合动电位极化曲线、周期浸润腐蚀质量损失结果以及表面微观形貌分析结果可知,污染海洋大气中的侵蚀性离子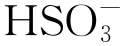 对纯Al表面氧化膜具有极强的破坏性,导致纯Al在该环境中面临严重的腐蚀问题。
对纯Al表面氧化膜具有极强的破坏性,导致纯Al在该环境中面临严重的腐蚀问题。
3. 结论
(1)纯Al在3.5% NaCl+0.02 mol/L NaHSO3溶液中表现出更大的腐蚀电流密度和更低的自腐蚀电位,即在此环境中纯Al的腐蚀速率和腐蚀倾向均高于其在3.5% NaCl溶液中的。
(2)周期浸润加速试验表明,纯Al在模拟污染海洋大气环境中面临严重的腐蚀问题,其腐蚀速率是在模拟海洋大气环境中的4倍,且污染海洋大气环境会导致更早和更严重的点蚀行为。
(3)污染海洋大气中的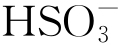 是诱发纯Al发生严重腐蚀的根本原因。侵蚀性离子
是诱发纯Al发生严重腐蚀的根本原因。侵蚀性离子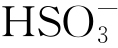 诱导纯Al表面保护性氧化膜转变成疏松的Al2(SO4)3,导致薄液膜的酸性和导电性均增加,从而促进腐蚀反应的发生。
诱导纯Al表面保护性氧化膜转变成疏松的Al2(SO4)3,导致薄液膜的酸性和导电性均增加,从而促进腐蚀反应的发生。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414