| 元素 | Fe | C | S | P | Si | Mn |
|---|---|---|---|---|---|---|
| 质量分数/% | 99.99 | 0.003 | 0.002 | 0.002 | 0.002 | 0.001 |
铀(U)是高放废物深地质处置研究的关键核素,主要包括U6+、U5+和U4+三种氧化态,虽然也存在U(III)氧化态,但其化学性质十分不稳定[1-4]。其中U6+具有较高的溶出性,极易形成线性铀酰(O=U=O)2+,与氢氧化物和碳酸盐反应生成可溶性络合物。在弱酸到碱性的范围内,U6+形成的化合物难溶于水[5-6]。U5+在水溶液中很不稳定,易发生歧化,其水化学性质研究比较困难。在漫长的深地质处置过程中,金属处置容器会发生腐蚀失去屏蔽功能,导致地下水浸入。高放废物与浸入的地下水直接接触,发生氧化溶解。放射性核素铀会以U6+的形式溶解进入地下水中并发生扩散迁移,对生物圈产生极大的危害[7-8]。
近年来,作为我国金属处置容器内衬结构的候选材料,铁基材料在模拟地下水条件下的耐蚀性及其对放射性核素的还原能力得到了广泛研究。LI等[9]研究了纯铁在模拟地下水溶液中的腐蚀,发现:Cl-的含量升高会加快纯铁的腐蚀,当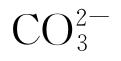 浓度达到20 mmol/L时,样品表面会很快形成钝化膜,从而提高纯铁的耐腐蚀性能。文怀梁等[10]在无氧条件下研究了
浓度达到20 mmol/L时,样品表面会很快形成钝化膜,从而提高纯铁的耐腐蚀性能。文怀梁等[10]在无氧条件下研究了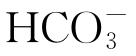 含量对低碳钢腐蚀活化/钝化状态的影响,发现:在0.01 mol/L
含量对低碳钢腐蚀活化/钝化状态的影响,发现:在0.01 mol/L 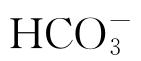 溶液中长期浸泡后,低碳钢发生阳极溶解,处于极限扩散状态,而在
溶液中长期浸泡后,低碳钢发生阳极溶解,处于极限扩散状态,而在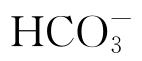 浓度高于0.02 mol/L溶液中长期浸泡后则处于钝化状态;主要腐蚀产物为α-FOOH和Fe3O4。CUI等[11-13]研究了模拟地下水低氧环境中纯铁与U6+的氧化还原反应,发现纯铁表面生成了绿锈和微米尺寸的UO2晶体;进一步研究了铀、锝、镎和钚在铁容器表面的还原沉积作用,结果发现铁及其腐蚀产物可使溶液中的铀(VI)、锝(VII)、镎(V)、钚(VI)等还原沉积在其表面。
浓度高于0.02 mol/L溶液中长期浸泡后则处于钝化状态;主要腐蚀产物为α-FOOH和Fe3O4。CUI等[11-13]研究了模拟地下水低氧环境中纯铁与U6+的氧化还原反应,发现纯铁表面生成了绿锈和微米尺寸的UO2晶体;进一步研究了铀、锝、镎和钚在铁容器表面的还原沉积作用,结果发现铁及其腐蚀产物可使溶液中的铀(VI)、锝(VII)、镎(V)、钚(VI)等还原沉积在其表面。
尽管深地质处置相关领域的研究较多,但是地下水体系十分复杂,即使同一地点不同深度的地下水在成分及pH上也有差别[14]。其中,pH不仅会对铁基材料的腐蚀产生影响,也会影响溶液中U6+与金属离子及无机配体的相互作用,以及U6+的还原沉积[15-17]。目前在深地质处置领域,关于pH影响的研究很少。探明pH对深地质处置环境中纯铁的腐蚀行为及纯铁还原U6+的影响具有非常重要的意义。
作者在不同pH的含U6+模拟地下水溶液中对纯铁进行了电化学测试和浸泡腐蚀试验,并结合电感耦合等离子体发射光谱仪(ICP-OES)、扫描电镜/能谱(SEM/EDS)和X射线光电子能谱分析(XPS)等分析表征方法,探讨了pH对纯铁在该环境中腐蚀行为及还原沉积U6+的影响。
1. 试验
1.1 试样与溶液
试验材料为纯铁,其化学成分见表1。将纯铁制成两种尺寸的试样。(1)尺寸为20 mm×20 mm×2 mm的片状试样,用于浸泡腐蚀试验,试样表面经过砂纸逐级打磨后,用无水乙醇冲洗并吹干,再置于干燥皿中备用。(2)尺寸为10 mm×10 mm×2 mm的试样,用于电化学测试,用电烙铁在其背面焊上纯铜导线,再用环氧树脂密封,工作面积为1 cm2;用砂纸逐级打磨电极工作面,再将其置于P-2T金相抛光机上用金刚石研磨膏(W2.5)与水抛至镜面;然后,将电极放入超声清洗仪中清洗,再用无水乙醇冲洗,吹干后,置于干燥皿中备用。
试验所需的化学试剂均为分析纯,由国药集团北京化学试剂公司生产。试验溶液为模拟地下水,含10 mmol/L NaCl、2 mmol/L NaHCO3、5 mmol/L CaCl2,由超纯水配制而成。往模拟地下水溶液中添加由UO2(NO3)2·6H2O配制的含U6+溶液,制备得到含U6+模拟地下水溶液(10 mmol/L NaCl+2 mmol/L NaHCO3+5 mmol/L CaCl2+10 mg/L U6+)。
1.2 电化学测试
采用CHI660E电化学工作站进行电化学测试。测试选用三电极体系,其中纯铁试样为工作电极,铂网电极为辅助电极,饱和甘汞电极为参比电极。测试前,向溶液中通入高纯氮气20 min,除去溶液中的溶解氧。接着分别用稀HNO3和NaOH溶液调节溶液pH至5.2、6.2、7.2、8.2和9.2,最后再通5 min氮气后作为电解质溶液,通过水浴控制反应温度为25 ℃。首先进行开路电位的测试,待电位稳定后,再进行相应的电化学测试。测试电化学阻抗谱时,扰动电压为10 mV,频率范围为10-2~105 Hz。测试动电位极化曲线时,电位设置范围相对开路电位为-0.3~+0.8 V,扫描速率为1 mV/s。
1.3 浸泡腐蚀试验
模拟含U6+地下水环境对纯铁进行浸泡腐蚀试验,设置两组平行试样。向配制好的含U6+模拟地下水溶液中持续通入高纯氮气鼓气20 min除去溶解氧,接着分别用稀HNO3和NaOH溶液调节溶液pH至5.2、6.2、7.2、8.2和9.2,再通5 min氮气后,迅速将试样悬挂于反应器内并盖上盖子,通过水浴控制反应温度为25 ℃,浸泡时间为336 h。在浸泡至0、24、48、72、168,336 h时,分别取水样1 mL,取样后进行重复鼓气操作,样品采用稀硝酸酸化保存。
1.4 观察与分析
用0.22 μm水系滤膜过滤浸泡试验采集的水样,利用Agilent 5110型ICP-OES检测溶液中U的含量。将浸泡试验后的纯铁试样用冷风吹干后,利用Apreo S Hivac型SEM/EDS对腐蚀产物进行形貌及元素分析。利用ESCALAB 250XI型高分辨率XPS光谱仪对不同pH含U6+模拟地层水中极化后纯铁表面腐蚀产物的成分结构进行分析。
2. 结果与讨论
2.1 动电位极化曲线
图1为纯铁在不同pH的含U6+模拟地下水中的动电位极化曲线,表2为相应的拟合结果。从图1中可以看出,在pH为5.2和6.2的条件下,测得的极化曲线形状相似,阳极极化均表现为活化溶解的过程。但在pH为7.2~9.2的条件下,阳极极化区域出现钝化区,这表明纯铁试样表面产生了钝化膜。从表2的拟合数据可知,随着溶液pH的增大,纯铁自腐蚀电位逐渐正移,腐蚀电流密度逐渐减小。这说明随着pH的升高,纯铁在含U6+模拟地下水溶液中的腐蚀倾向减小,腐蚀速率减缓。其原因是,在弱酸性条件下,溶液中H+含量较大,使纯铁试样表面活性增强,加速试样的腐蚀;在弱碱性条件下,纯铁试样表面形成钝化膜,对纯铁的腐蚀起到抑制作用,进而提升了纯铁试样的耐蚀性。
| pH | Ecorr/V | Jcorr/(A·cm-2) |
|---|---|---|
| 5.2 | -0.737 | 2.500×10-6 |
| 6.2 | -0.632 | 1.989×10-6 |
| 7.2 | -0.602 | 1.592×10-6 |
| 8.2 | -0.608 | 1.076×10-6 |
| 9.2 | -0.570 | 7.611×10-7 |
2.2 电化学阻抗谱
纯铁在含U6+模拟地下水中的电化学阻抗谱(EIS)如图2和3所示。从Nyquist图可见:不同pH条件下,电化学阻抗谱均为单一的容抗弧,未出现斜率为45°直线段,表明不同pH条件下纯铁试样的反应机制相同,均由电荷转移过程控制;随着pH的降低,容抗弧半径逐渐减小,当pH为9.2时容抗弧半径最大,pH为5.2时容抗弧半径最小。高频区的容抗弧与界面电荷的传递及金属表面钝化膜的致密性相关。容抗弧的半径越大,电荷转移电阻越大,试样的耐腐蚀性能越好。所以随着pH的降低,纯铁在含U6+模拟地下水环境中的耐蚀性逐渐降低。结合Bode图及纯铁在模拟地下水溶液中腐蚀电化学体系特征,用Zview软件拟合得到该腐蚀体系的等效电路如图4所示。相应拟合获得的溶液电阻Rs、常相角元件参数Y0以及电荷转移电阻Rt等电化学参数如表3所示。从拟合数据可以看出,随着pH的增大,电荷转移电阻逐渐增加,这表明纯铁的耐蚀性逐渐提升。
| pH | Rs/(Ω·cm2) | Rct/(Ω·cm2) | Y0/(S·s-n·cm-2) |
|---|---|---|---|
| 5.2 | 129.4 | 2 635 | 1.90×10-4 |
| 6.2 | 121.2 | 5 248 | 1.75×10-4 |
| 7.2 | 128.7 | 6 099 | 1.50×10-4 |
| 8.2 | 123.8 | 10 305 | 1.39×10-4 |
| 9.2 | 126.7 | 17 180 | 2.38×10-4 |
2.3 模拟地下水中U含量的变化
图5为不同pH条件下模拟地下水中U含量随浸泡时间的变化曲线。从图5中可以看出,在试验选取的pH范围(5.2~9.2)内,在初始浸泡的72 h内U的含量都快速下降。这是因为加入的纯铁具有较强的还原性。在pH为5.2的模拟地下水中,U质量浓度在72 h内由10 mg/L下降至2.1 mg/L;在pH为6.2的模拟地下水中,U质量浓度在72 h内由10 mg/L下降至3.3 mg/L;在pH为7.2的模拟地下水中,U质量浓度在72 h内由10 mg/L下降至2.1 mg/L;在pH为8.2的模拟地下水中,U质量浓度在72 h内由10 mg/L下降至5.2 mg/L;在pH为9.2的模拟地下水中,U质量浓度在72 h内由10 mg/L下降至8.8 mg/L。对比发现,在pH为5.2的模拟地下水中,U含量下降最快,在pH为9.2的模拟地下水中,U含量下降最慢。结合电化学测试结果可知,在pH为5.2的模拟地下水中,纯铁腐蚀速率最快,相应生成的腐蚀产物最多,更易吸附溶液中U6+,因此还原沉积速率最快。在pH为9.2的模拟地下水中,由于钝化膜的产生,腐蚀产物生成较少,U6+还原沉积速率减缓。浸泡时间超过72 h后,随着浸泡时间的延长,溶液中U含量下降并逐渐趋于稳定,这与U6+还原沉积导致纯铁的活性表面积减少有关。
2.4 腐蚀产物形貌和组成元素
图6为在不同pH的含U6+模拟地下水溶液中浸泡336 h后纯铁表面的腐蚀形貌。从图6中可以看出,当pH为5.2时,腐蚀产物呈现凸起的堆积状态;当pH为7.2时,龟裂状腐蚀产物覆盖纯铁的表面,产物间较为疏松;当pH为9.2时,颗粒状和块状的腐蚀产物紧密附着在试样表面。通过对比不同pH条件下纯铁表面腐蚀形貌,发现:在pH为5.2条件下纯铁的腐蚀程度最严重,随着pH的增大,腐蚀程度逐渐减缓;在pH为9.2条件下,腐蚀产物较为致密,对基体的保护作用较好,故纯铁腐蚀最轻。
以pH为7.2条件下的纯铁试样为例进行EDS点分析和面分析,结果如图7和表4所示。从图7可见,经浸泡腐蚀试验后纯铁试样表面的主要元素为Fe、O、U,沉积的U在腐蚀层中呈现均匀分布。点1处主要为Fe基体,Fe的质量分数为89.07%,点2处U的质量分数为73.04%,Fe的质量分数为6.15%,这说明溶液中的U6+发生还原沉积并以氧化物的形式附着在试样表面。点3处Fe的质量分数为66.48%,U的质量分数为2.09%,O的质量分数为23.41%,此处的腐蚀产物主要为铁氧化物。
| 位置 | 质量分数/% | ||||||
|---|---|---|---|---|---|---|---|
| Fe | U | O | Ca | C | Na | Cl | |
| 点1 | 89.07 | 0 | 7.55 | 0.36 | 2.54 | 0.23 | 0.25 |
| 点2 | 6.15 | 73.04 | 11.58 | 3.94 | 4.93 | 0.21 | 0.15 |
| 点3 | 66.48 | 2.09 | 23.41 | 0.99 | 3.84 | 0.12 | 3.07 |
2.5 XPS谱
为进一步分析腐蚀产物的成分结构,对极化后的纯铁试样进行Fe、O、U等元素的XPS精细谱扫描,并用XPSPEAK41软件拟合,结果如图8所示。从图8(a,c)中可见,在Fe 2p芯能级谱线711.4 eV和725 eV附近可观察到Fe 2p3/2和Fe 2p1/2的两个峰,并且在720 eV附近也均有另外一个卫星峰(弱峰),这个卫星峰归属于Fe3+[18-19]。对于Fe 2p2/3峰,可以被解卷积成两个不同的分量,分别对应于Fe3+和Fe2+。O 1s芯能级被解卷积成三个子峰,分别对应于O2-(晶格)、OH-(晶格)、OH-(ads)。529 eV附近的峰归属于氧化铁晶格中的O2-,表明腐蚀产物中存在FeO、Fe2O3和Fe3O4。FeO不稳定,极易被氧化为Fe3O4,所以铁的氧化物主要是Fe2O3和Fe3O4。531.6 eV附近的峰对应于氢氧化铁晶格中的OH-,表明铁锈中可能存在Fe(OH)3和FeOOH。533 eV附近的峰对应于OH-的吸附,特别是对H2O的解离吸附[20-21]。在U4f芯能级381.1 eV和391.9 eV出现两个主峰,分别对应于U4f7/2和U4f5/2。U4f7/2和U4f5/2解卷积成四个不同的分量,分别代表U6+(381.9 eV,392.6eV)和U4+(380.5 eV,391.4 eV)[22-23],说明纯铁试样表面存在U6+和U4+。结合CUI等[11-13]的研究,推测纯铁试样将溶液中的U6+还原沉积为UO2。纯铁表面氧化生成腐蚀产物,一部分U6+会先被腐蚀产物吸附随后再被还原为UO2沉积。
3. 结论
(1)随着含U6+模拟地下水溶液pH的升高,纯铁的自腐蚀电位逐渐正移,腐蚀电流密度逐渐减小,电荷转移电阻增大,说明其耐蚀性随着pH的增大而增强。
(2)在含U6+模拟地下水溶液中,纯铁的腐蚀产物主要为Fe2O3、Fe3O4、Fe(OH)3和FeOOH。
(3)纯铁能将溶液中的U6+还原沉积为UO2。初始的72 h内,pH为5.2的溶液中U6+还原沉积速率最快,随着pH升高,U6+还原沉积速率逐渐减缓。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414





 下载:
下载: 







