摘要
基于再生水管道 (无内衬球墨铸铁管) 腐蚀模拟实验装置,选取pH、总硬度、SO42-和Cl-等开展多水质因素腐蚀实验,采用电化学测试方法和挂片失重法,研究了再生水管道的瞬时腐蚀速率、平均腐蚀速率与腐蚀垢层阻抗特性的变化规律。结果表明,电化学测试所得瞬时腐蚀速率、挂片失重法所得平均腐蚀速率与腐蚀垢层阻抗变化规律具有一致性。正交试验结果表明,水质因素对球墨铸铁管腐蚀影响程度排序为:pH>总硬度>SO42->Cl-;偏酸性、低硬度的水体更易造成管道腐蚀,且水体低pH对管道腐蚀最为明显;偏碱性的水体在减少管壁腐蚀的同时,促进管道形成管垢保护管壁;阴离子浓度越高,垢层扩散阻抗值越小,垢层越不稳定。
关键词: 再生水; 管道腐蚀; 瞬时腐蚀速率; 平均腐蚀速率; 腐蚀垢层阻抗
近年来,在我国城镇化建设过程中,水资源短缺问题日益凸显,作为城市“第二水源”的城市污水再生利用工程备受关注。我国污水资源化利用技术在“十五”至“十二五”期间发展迅猛,多项示范工程得到推广,并逐步将再生水供水管网纳入城市供水规划当中[1]。面对我国水资源严峻匮乏及水源水遭受污染的现状,再生水技术有效地缓解了我国城市用水的供需紧张难题,为“绿水青山”建设提供了强有力的支持[2]。
目前,国内外的再生水回用在输配过程中仍存在一定的待解难题。因再生水的水质特殊,其与管道内壁表面反应复杂,加速管道腐蚀,进而引起管网的漏损和爆管等问题。刘喆等[3]通过失重法和电化学法考察了再生水对铸铁的腐蚀特性,并考察了初始pH和含盐量对铸铁腐蚀的影响。张雅君等[4]基于碳钢管网水质条件和水力流动状态,从腐蚀速率、Fe释放等方面,研究了Larson指数对碳钢腐蚀的影响。Liu等[5]通过分析铸铁管道内微生物生长与管道腐蚀的关系得出,再生水中丰富的微生物是引起管道腐蚀的主要原因之一。Lee等[6]通过比较研究自来水和再生水对不同管材 (镀锌钢管、铸铁管、不锈钢管和聚氯乙烯管) 的管道内壁腐蚀的影响,评价了相关缓蚀剂对不同管材腐蚀的减缓效果。Cui等[7]研究了不锈钢腐蚀垢和腐蚀钝化膜的形态、矿物学和化学特征,揭示了再生水通过不锈钢管输送时的腐蚀行为,通过表征及光谱法检测得到结论:不锈钢的局部腐蚀行为与再生水的余氯、溶解氧 (DO)、Cl-、SO42-等水质参数有关。
然而,国内外众多学者对再生水管道的研究大多集中在不同管材的腐蚀情况,以及管道内微生物、消毒剂、再生水水质等因素对管材腐蚀的影响。由于再生水对管道的腐蚀是多种因素共同作用的结果,故本文搭建了再生水管道 (无内衬球墨铸铁) 腐蚀模拟实验装置,探索多水质因素条件下再生水管道的电化学腐蚀过程,分析水质因素对再生水管道腐蚀的影响,以期为研发实用的再生水管道防腐技术提供理论依据,对多角度掌控管道腐蚀规律以及保障再生水系统运营安全提供参考数据。
1 实验方法
1.1 实验设计
实验用水取自天津市某再生水厂泵房出水,实验期间每天对水质指标进行监测,各指标均值见表1。选取pH值、总硬度、SO42-与Cl-为控制指标,根据水质波动情况选取各指标的3个水平梯度,设计L9(34) 试验,模拟多因素水质条件下管道的腐蚀情况,各组实验进行5~7 d,正交试验设计见表2。本实验研究的管材采用球墨铸铁管及相应材质的挂片,管材化学成分 (质量分数,%) 为:Mn 0.500,Fe 93.705~94.635,C 3.596~3.780,S 0.026,Si 1.200~1.900,P 0.068。
表1 再生水厂出水水质指标

表2 正交试验方案表

为满足实验用水条件,以再生水为基础腐蚀介质。实验期间为夏季,室温稳定在约28 ℃,实验水温为18~22 ℃。通过调节循环泵控制流量,调节电化学测试装置内的水流速率为0.3 m/s。调节水箱内的O2/N2充气装置的进气比例,达到实验所需DO浓度为 (6±0.5) mg/L。使用稀HNO3溶液和稀NaOH溶液调节pH,波动范围为±0.05。预先将再生水进行曝光24 h处理,使再生水中总余氯含量基本为零;然后添加稀NaClO溶液调节总余氯,波动范围为±0.5 mg/L。对于低于再生水目标值的梯度水质,按比例使用蒸馏水稀释。对于高于目标值的水质,添加稀CaN2O6溶液 (由基准CaCO3固体和稀HNO3配制而成),调节总硬度,波动范围为±5 mg/L;通过加入对应的钠盐NaCl与NaSO4,调节Cl-和SO42-浓度。
本研究的分析检测法主要为电化学测试法和挂片失重法。采用电化学动电位线性扫描法测算瞬时腐蚀速率,使用电化学阻抗谱 (EIS) 分析水质条件对腐蚀垢层及腐蚀过程的反应机理;通过挂片失重法计算平均腐蚀速率。本实验的主要水质检测项及方法见表3。
表3 水质检测项及方法

1.2 实验装置
1.2.1 电解池
本实验在管道装置的基础上采用电化学工作站进行检测,通过开路电位和线性极化采集数据。据相关实验要求设计电解池,如图1所示。电解池的工作电极为直径1 cm可替换的球墨铸铁片,参比电极为AgCl/Ag电极 (电极内盐桥为配制的饱和KNO3溶液),辅助电极为铂片电极 (2 cm×2 cm,厚0.3 mm)。球墨铸铁工作电极预处理:依次用600#、800#、1000#、1200#、1500#和2000#金相砂纸逐级打磨,并用抛光粉抛光,丙酮中除油分,无水乙醇脱水,干燥24 h。

图1 电解池构造图
1.2.2 再生水管道腐蚀动态实验装置
以电解池为核心,与电解池串联搭建动态再生水管道腐蚀实验模拟装置,整套装置水流顺序为:水箱出水→蠕动泵→电解池→挂片装置→水流循环回水箱。各装置间以硅胶管连接,如图2所示。设置两套装置并联,取其中一套作对照实验。柱形水箱盖顶预留圆孔,用于溶解氧检测与通气;水箱底部设有简易曝气装置,通入氮气以保持水源的溶解氧含量稳定;挂片装置中部沿再生水流动方向装有6个可拆卸的球墨铸铁片,尺寸为2.5 cm×2.5 cm,厚7.5 cm。

图2 动态循环再生水中金属腐蚀实验装置
1.3 电化学腐蚀测试方法
本研究使用CS350电化学工作站与测试软件CorrTest结合进行电化学检测,分别对各组实验在0~120 h内 (具体监测时间为5,24,48,72,96和120 h),采用动电位扫描-线性极化测试的方法,监测各实验组金属电极的瞬时腐蚀速率变化。并在各组实验进行至第120 h时进行动电位扫描-强极化测试,得到稳定腐蚀期的腐蚀速率。待腐蚀速率达到稳定阶段后,对各组进行EIS测试,得到稳定腐蚀期的垢层电化学阻抗特征。
进行动电位扫描测试时,线性极化扫描电位为-0.015~0.015 V (相对开路电位),扫描速率为0.5 mV/s;强极化扫描电位为-0.12~0.12 V (相对开路电位),扫描速率为0.5 mV/s。电化学阻抗谱测试时,交变幅值为10 mV,频率测试范围为105~10-2 Hz。
1.4 挂片腐蚀失重实验
为论证瞬时腐蚀速率变化规律,在电化学检测实验阶段同时开展了挂片腐蚀失重实验,经过相同的实验时长,并在对应时间点将与电解池工作电极同材料的铸铁试片取出。以质量差的形式计算,求得平均腐蚀速率v(mm/a):
![]()
式中,Δm为质量损失,g;ρ为金属试片密度,g/cm3;S为金属挂片表面积,cm2;t为腐蚀周期,h。
2 结果与讨论
2.1 再生水管道的瞬时腐蚀速率
2.1.1 瞬时腐蚀速率随时间的变化
基于各组实验的线性极化曲线和强极化曲线,分别通过Rp拟合和Tafel斜率外推法计算瞬时腐蚀速率[8],绘制各组试样瞬时腐蚀速率随时间的变化曲线,见图3。

图3 瞬时腐蚀速率随时间的变化
由图3可知,0~5 h内瞬时腐蚀速率普遍偏高,说明腐蚀初期反应最强烈,这是由于在腐蚀初期管道内壁比较光滑,再生水中的离子与管道表面的Fe直接碰触并反应[9];在5~48 h时段内,各组瞬时腐蚀速率快速下降,进入管道腐蚀的中期,管道内壁生成的腐蚀产物呈现出疏松多孔的形态,由光滑的管道壁面转化为有腐蚀产物覆盖的粗糙垢面,随着垢层的进一步致密,腐蚀速率逐步降低;在48~120 h时间段,管壁表面开始形成一层稳定的腐蚀垢层,导致腐蚀稳定在较低水平,腐蚀速率曲线基本呈现出平稳状态。在水质因素的差异影响下,各组试样腐蚀速率稳定值也表现出一定的差异,但基本稳定在0.1500~0.2500 mm/a。相较于本课题组研究的自来水管道腐蚀速率 (0.1000~0.1500 mm/a)[10],在再生水中的稳定腐蚀速率明显要高。
2.1.2 水质因素的影响
在正交试验的基础上,以极差分析法研究多因素水平对管道腐蚀过程的影响,极差分析见表4。由表4正交试验计算可得,各水质因素对腐蚀速率影响的主次顺序为:pH>总硬度>SO42->Cl-。
表4 瞬时腐蚀速率极差分析表
初始pH对腐蚀的影响较为显著,且pH越低,对腐蚀的促进作用越明显。这主要是因为,酸性条件下H+浓度较高,可以作为阴极去极化剂参与到球墨铸铁的电化学腐蚀过程中;而在碱性环境下,管道表面会形成少量CaCO3积垢抑制腐蚀反应的发生。
总硬度对腐蚀的影响也较为明显。水的总硬度为水体内的Ca2+和Mg2+的总浓度,其中碳酸盐硬度是水中Ca2+和Mg2+以酸式的碳酸盐形式表现。因其具有多种阴阳离子,较高硬度的水促进管道结垢、减缓腐蚀,所以总硬度是影响再生水对管道腐蚀的重要因素。
Cl-与SO42-对腐蚀的作用较弱。因它们具有可穿透稀疏腐蚀垢层的特性,更易于进入到金属表面,且能破坏已形成的腐蚀垢层。因此,在腐蚀初期,Cl-与SO42-对腐蚀的影响较明显。但随着时间的推移,形成的腐蚀垢层逐步变得更加密实,Cl-与SO42-对致密垢层的穿透能力减弱,所以在腐蚀后期,Cl-与SO42-对管壁的腐蚀作用不明显。
球墨铸铁管的腐蚀主要表现为腐蚀性阴离子破坏原管壁表面成分组成的钝化膜作用[11]。球墨铸铁管的主要垢层成分为FeOOH,体积较小的Cl-和SO42-能够穿透钝化膜层,取代该膜层间金属离子的氢键,使得FeOOH的活性基团遭到损坏并暴露出来,与Cl-和SO42-发生微形态下的表面化学反应,导致Fe2+或Fe3+的释放。又因为硬度较大时,SO42-已介入垢层的形成,且SO42-自身的电荷量较高,电子转移能力优于Cl-[12,13],故SO42-对管道的腐蚀效果与Cl-相比较为明显。
本课题组之前研究过多因素对球墨铸铁管内衬-水泥砂浆管道的腐蚀作用[14],结果表明Cl-比SO42-对水泥砂浆管道的腐蚀作用明显,其机理是由于Cl-的存在会促使Ca(OH)2的溶出加速,水泥砂浆会先在Cl-的作用下,消耗其中的C3A(3CaO·Al2O3);而SO42-只能与上述反应后剩余的C3A反应,再进入下一阶段的腐蚀。由此可见,不同管材受水质影响的腐蚀情况不尽相同。
2.2 再生水管道的平均腐蚀速率
正交试验中,通过各组实验求得单个挂片的平均腐蚀速率,再在各组中求得组内的失重平均腐蚀速率,计算方法见1.4,正交试验方案见表2,9组平均腐蚀速率分别为0.0727,0.0728,0.0627,0.0512,0.0769,0.0789,0.0539,0.0481和0.0699 mm/a。
通过各组平均腐蚀速率分析可知:(1) 初始pH对最终稳定后的腐蚀速率影响最大。初始pH为9的第4和8组实验的腐蚀速率低于其他组的,pH为9的第3组实验的腐蚀速率也处在较低水平。而pH为6和7.5的其他6组的腐蚀速率终稳值与初始腐蚀速率差别较大,酸性再生水促进腐蚀。Larson指数与Langelier饱和指数对腐蚀的倾向也说明,较高的pH在一定程度上可以抑制Fe的电化学腐蚀[15]。(2) 高硬度抑制腐蚀。第1~3组实验的腐蚀速率明显高于第7~9组的。显然,高硬度水质会抑制腐蚀反应进行。推测可得,高硬度的水质易与水体内相关离子结合,或易与初期管垢反应沉积在管壁附近,增厚垢层并使其紧密,减缓腐蚀。(3) SO42-促进腐蚀。SO42-值最高的为第3、6、9组实验,这3组实验的其他因素均不一致且各有抑制腐蚀的因素值,但这3组的腐蚀速率均处于中等偏上的位置,推测SO42-对腐蚀速率具有一定的促进作用。这3组实验相较于Cl-浓度较大的第3、5、7组实验而言,腐蚀速率整体略高于后者的。故初步分析认为,SO42-较Cl-对腐蚀速率有着更为明显的影响。(4) Cl-对腐蚀速率的影响较小。比较Cl-浓度最大的3组实验 (第3、5、7组实验),其腐蚀速率却不都是最大的,有高有低。分析其原因,第5组实验腐蚀速率最高,该组pH最低,是腐蚀速率高的主要影响因素;第7组实验腐蚀速率较低,该组的pH处在中等值,但硬度很高,是影响腐蚀速率较低的主要因素之一;第3组实验,因其高SO42-、Cl-值、低硬度值促进腐蚀,但高pH却减缓了腐蚀,既有促进又有抑制,二者交互作用使得腐蚀速率处于中等值。此外,9组实验中腐蚀速率较高 (0.2000 mm/a以上) 的几组实验,大都为pH低且硬度也低,而Cl-浓度分布在整个实验梯度范围,说明Cl-对腐蚀速率影响较小。
综合比较,Cl-值对腐蚀速率的影响程度要小于pH和硬度,Cl-和SO42-对腐蚀速率的影响还待进一步考证。
2.3 再生水管道腐蚀垢层阻抗特性分析
2.3.1 垢层的电化学阻抗
本研究在各组实验运行稳定后至第96 h时进行EIS测试,图4为Nyquist图,图5是Bode图。
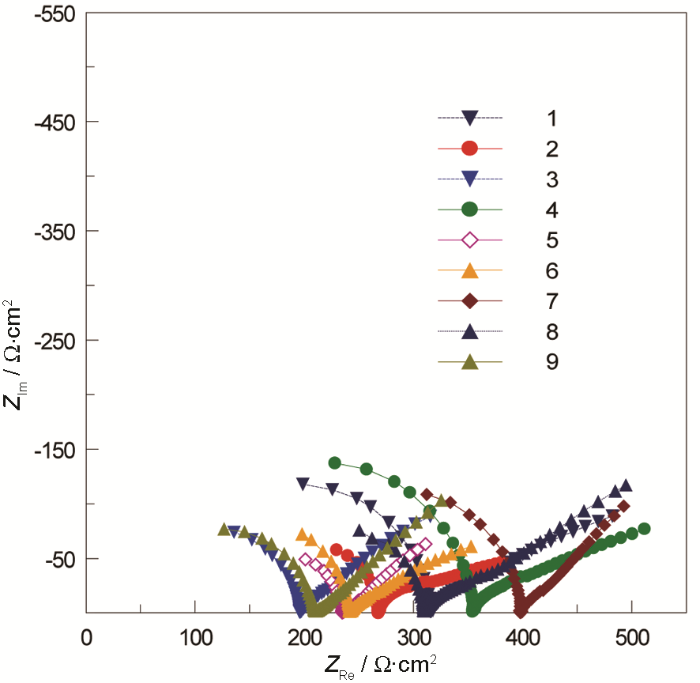
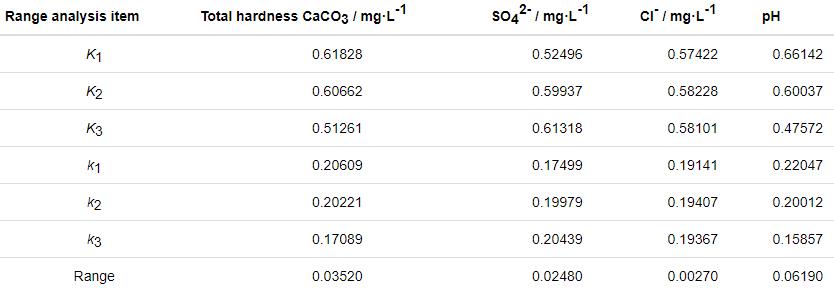
图4 正交试验阻抗分析Nyquist图
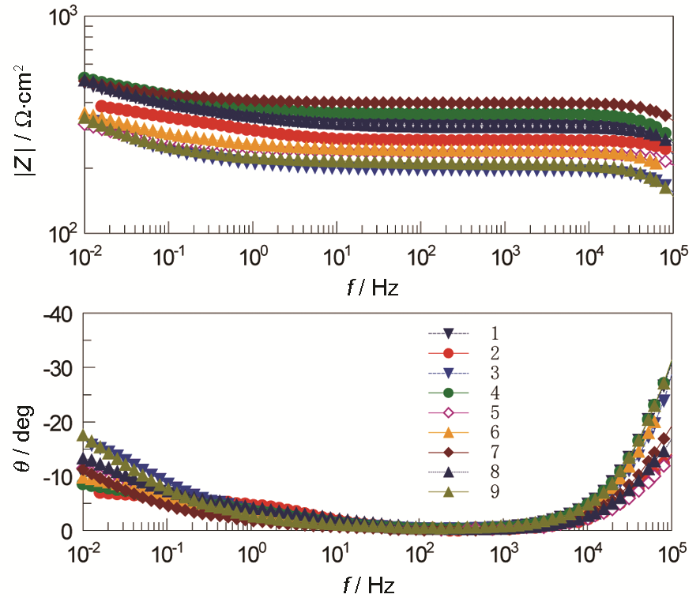
图5 正交试验阻抗分析Bode图
从Nyquist图可知,各组正交试验的电化学阻抗谱图均由高频容抗弧和低频Warburg阻抗两段组成。容抗弧随着时间的发展在逐渐变大,说明腐蚀垢层一直在发展,而出现Warburg阻抗则说明反应后期的腐蚀垢层较为致密,腐蚀产物已基本稳定。对Bode图整体观察可以看出,阻抗Z随频率的加大,其变化并不显著。分析说明,在该阶段虽然腐蚀反应还持续着,但因腐蚀产物逐渐积累成的垢层会减缓腐蚀,转而进入稳定的腐蚀阶段。
由图5可知,实验第4、7、8组对应组内的pH较大、硬度较大、阴离子也处在中等水平,这几组实验的阻抗弧半径大于其他组的;第6组和第9组阻抗弧半径小于其他几组的,这两组pH最小;第2组阻抗弧半径小于其他几组的,该组硬度最小,其他影响因素也处于较低水平。综合分析,pH和硬度对阻抗值影响较大,偏碱性、高硬度的体系阻抗值较大,从而减缓腐蚀。
2.3.2 垢层阻抗与水质因素的影响
根据EIS图出现了高频容抗弧和低频Warburg阻抗的特征,采用如下等效电路[16,17](图6) 对EIS数据进行拟合。其中,Rs为溶液电阻,Rf为腐蚀垢层的等效电阻,C为腐蚀垢层的等效电容,W为Warburg阻抗。
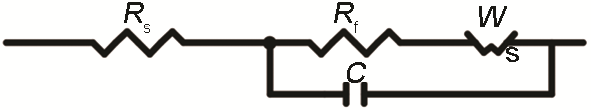
图6 等效电路
基于图6的等效电路,通过ZView2软件对正交试验的EIS数据进行拟合,结果见表5。
表5 等效电路拟合结果
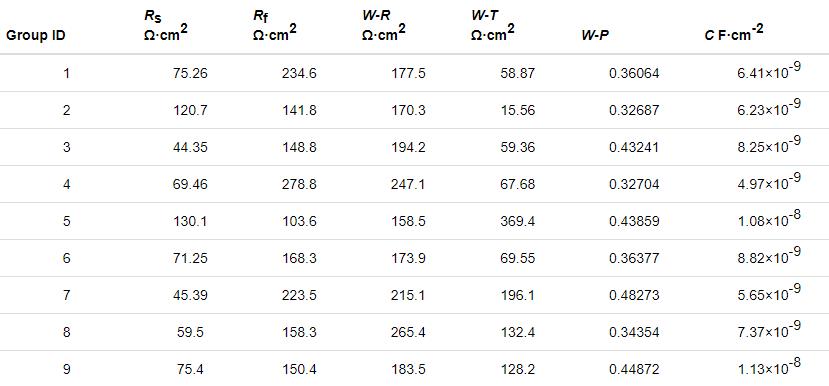
该等效电路由扩散行为控制,扩散速率取决于导纳,即阻抗的倒数 (用Y表示),Y越大,越易形成离子扩散。又因导纳与阻抗 (Zw) 存在Zw=1/Y的关系,而作为阻抗Zw特性的重要参数—W-R[18],可将扩散行为分析简化成阻抗参数分析。由此选取正交试验中W-R、Rs、Rf的变化量作图7,以此对扩散行为作定量评价。由图7可知,Rf与W-R的变化规律近似,Rs的变化规律与Rf和W-R基本相反。
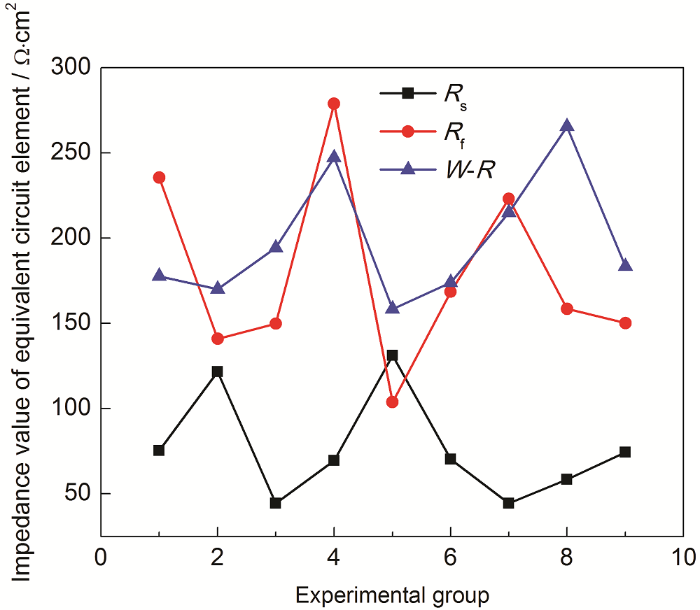
图7 正交试验阻抗值变化
阻抗分析最重要的是垢层转变部分。在水环境中作用于阻抗的阴离子主要是SO42-与Cl-,阴离子浓度高时可穿透垢层,致使垢层难以维持稳定。按实验列组分析W-R的变化规律可知,第3、4、7、8组实验的阻抗值显著高于其他组的,而这些组内的pH也较大,说明初期pH能够对垢层生长起较强的促进作用。由于Rf大于Rs,说明电子从腐蚀垢层传递到金属表面比电子从溶液传递到腐蚀垢层更加困难。
对正交试验的扩散阻抗做极差分析,以剖析垢层与各水质因素之间的关系。阻抗极差分析计算结果见表6。可知,Warburg极差分析与腐蚀速率的极差分析结果基本一致,pH对扩散阻抗的影响最为显著,各因素影响次序:初始pH>总硬度>SO42->Cl-。
表6 Warburg阻抗影响因素的极差分析计算

对比图7及表6可知:
(1) 初始pH的影响:整个正交试验调控的是进水pH,即实验初期的pH。随着体系的反应,各组反应使pH逐渐升高,而初期的碱性水体比酸性水体更易使后期水体偏碱性,故初期碱性水体可促进腐蚀垢层比较稳定的生成。腐蚀速率与阻抗测试结果表明,初期的碱性水质使腐蚀垢层平稳生长,垢层减缓了水体对管壁的冲蚀,更充分解释了反应中部时间段稳定下来的腐蚀速率小于初期酸性水质条件下的腐蚀速率。
(2) 硬度:水体内的沉积物会逐步被腐蚀产物吸附,在腐蚀反应早期渐渐形成了相对致密的基本垢层。所以Ca2+和Mg2+含量较多的高硬度水体能够促进早期平稳、相对致密的腐蚀垢层生成,致使腐蚀速率维持平稳。
(3) 阴离子影响:在阻抗分析中可见,阴离子浓度越高,生成垢层的扩散阻抗值反而越小,这是由于SO42-与Cl-在垢层生成时及腐蚀垢层基本成型后,对垢层内部金属键、氢键等作用力的阻挠和取代作用所致。
通过腐蚀速率和垢层阻抗作为正交试验结果进行极差分析和影响因素排序,结论基本一致。最终结果说明,垢层阻抗值可以作为评价管道腐蚀情况的一个有效指标。
3 结论
(1) 球墨铸铁在再生水中前期的腐蚀速率最大,48 h进入相对稳定的状态,96 h后基本趋于平缓,稳定腐蚀速率大致在0.15~0.25 mm/a。
(2) 通过失重法所得的平均腐蚀速率和基于电化学方法所得的瞬时腐蚀速率及阻抗特征分析,结果一致表明,各水质因素对球墨铸铁管道腐蚀影响的主次顺序为:pH>总硬度>SO42->Cl-。
(3) 偏酸性、低硬度的水体更易造成管道腐蚀,且水体低pH对管道腐蚀最为明显;偏碱性的水体既能减少管壁的腐蚀,又能促进管道形成管垢保护管壁,Cl-与SO42-对腐蚀的作用较弱。
(4) 在垢层生长中,pH对扩散阻抗的影响最为显著。阴离子浓度越高,垢层扩散阻抗值越小。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





