B30铜镍合金作为铜合金的一种,凭借良好的力学性能,抗海水腐蚀,抗冲刷腐蚀,优异的耐海洋生物污损等优点[1,2],20世纪30年代起被广泛用于舰船中船用冷凝器的制造[3-5]。
虽然B30铜镍合金应用于船用冷凝器的制造时间已久,但是在实际运行中仍然存在着严重的腐蚀问题,其中以孔蚀尤为突出,在使用中造成了巨大的危害[6-10],本文针对船用冷凝器出现的孔蚀问题进行研究。船用冷凝器投入应用前,需要在一定流速的海水中进行预处理,使其表面形成致密的保护膜,从而提高材料耐蚀性[11-15]。在进行预处理时,海水环境中影响B30铜镍合金成膜的因素有很多[16],最为重要的为海水的溶解氧浓度及流速。在不同的海域,海水盐度和温度的不同会影响海水的溶解氧浓度,同时海水的流速也会影响成膜过程中船用冷凝器周围海水中溶解氧浓度的变化[17-22]。成膜环境中海水流速的变化除了影响溶解氧浓度外,还会影响试样的表面状态。
本文以B30铜镍合金作为研究对象,通过改变海水中的溶解氧浓度以及海水的流速,研究B30铜镍合金的成膜机理及其在海水中的电化学特性,分析这两种因素对于成膜的影响,得到B30铜镍合金成膜的最佳条件,对实际工况中成膜工艺进行指导,帮助解决船用冷凝器存在的孔蚀问题。
1 实验方法
本文研究对象为B30铜镍合金,其化学成分为 (质量分数,%):C 0.05,Si 0.15,Mn 1.2,P 0.006,S 0.01,Pb 0.05,Fe 0.9,Ni+Co 29-33,Cu为余量。电化学测试的试样尺寸为10 mm×10 mm×3 mm,保留1 cm2工作面,其余面用环氧树脂密封。表面观察试样尺寸50 mm×10 mm×3 mm。试样表面依次用800#、1000#、2000#砂纸打磨,打磨后的试样依次用蒸馏水和无水乙醇清洗,吹干备用。
实验介质为青岛沙子口海域天然海水。海水的pH值为7.8,实验在室温下进行。实验中分别通过通氮气、不通气和通氧气的方式来控制海水的溶解氧浓度,采用YSI200溶解氧测量仪测试溶解氧浓度分别为:(3.5±0.1)、(8.0±0.1) 和 (14.0±0.1) mg/kg;通过调节磁力搅拌器的转速来控制海水流经试样表面的线速度,分别为:0,0.8和2.0 m/s。
电化学测试Gamry reference 600+电化学工作站上进行,采用三电极体系,工作电极为在不同海水体系中预处理后的B30铜镍合金,参比电极为饱和甘汞电极 (SCE),辅助电极为混合金属氧化物电极 (MMO),电化学阻抗 (EIS) 在开路电位下进行,施加幅值为10 mV的正弦波电位,扫描频率范围为105~10-2 Hz,对数扫频,每倍频程10个点。采用Gmini300的扫描电子显微镜 (SEM) 对材料表面保护膜进行形貌观察;采用ESCALAB 250Xi的X射线光电子能谱 (XPS) 对保护膜成分进行分析。
2 结果与讨论
2.1 海水中的溶解氧浓度对成膜的影响
开路电位在一定程度能够反映试样的腐蚀倾向。图1为B30铜镍合金在不同溶解氧浓度海水中的开路电位。
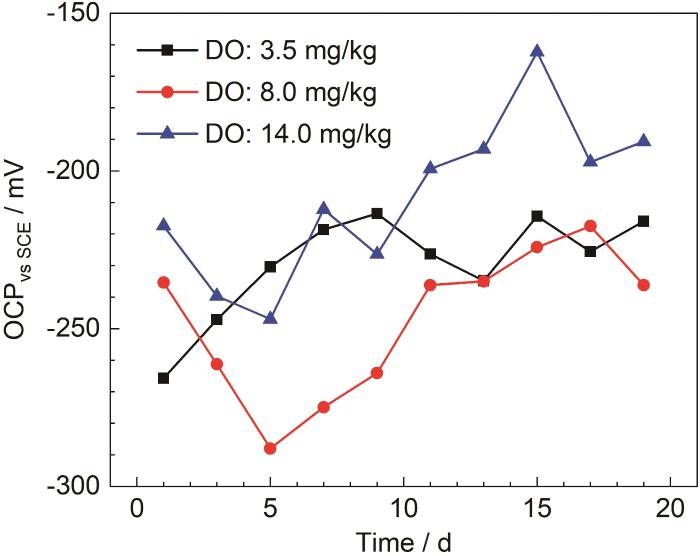
图1 B30铜镍合金在不同溶解氧浓度海水中的开路电位
由1 d的开路电位可以看出,海水中的溶解氧浓度越高,开路电位越正,腐蚀倾向越小,说明随着溶解氧浓度的提高,试样表面初期成膜越快。在DO为3.5 mg/kg的海水中,初期开路电位正移,腐蚀倾向减小,保护膜初步形成,9 d开始上下波动,膜层进入形成与溶解的波动状态。在DO为3.5和8.0 mg/kg的海水中,11 d前开路电位处于波动状态,膜层处于波动溶解阶段,11 d后开路电位趋于稳定,此时腐蚀倾向最小,表面形成保护膜,阳极溶解减缓[23]。11~19 d在DO为14.0 mg/kg的海水中开路电位相较其他两种海水更正,腐蚀倾向更小。
电化学阻抗谱 (EIS) 能够表征B30铜镍合金表面膜层的状态。图2为B30铜镍合金在不同溶解氧浓度海水中的EIS图。
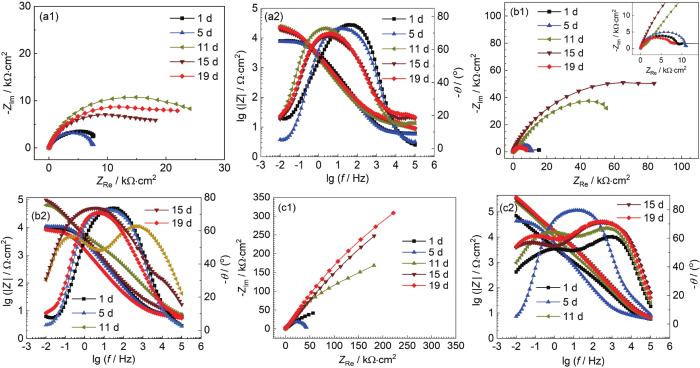
图2 B30铜镍合金在不同溶解氧浓度海水中的EIS图
由Nyquist图可见,在3种溶解氧浓度的海水中,容抗弧半径均波动增大。容抗弧半径的增大是由于试样表面形成了具有保护性的膜层,膜电阻增大,膜层增厚会阻碍阳极溶解过程,导致电荷转移电阻增大。对比3种溶解氧浓度海水的Nyquist图可以看出,随着溶解氧浓度的增大,容抗弧半径增大。在DO为3.5和8.0 mg/kg的低溶解氧浓度的海水中,形成的膜层较慢且不稳定,膜层仍然处于波动溶解状态,膜层溶解导致膜电阻减小,同时膜层的破裂导致电荷转移电阻减小,所以15~19 d,容抗弧仍有减小的趋势。
由Bode图可以看出,随着溶解氧浓度的提高,模值呈现增大的趋势,试样表面形成的膜层阻抗值增大。在DO为3.5 mg/kg的海水中,随着浸泡时间的延长,相位角向低频区移动,试样表面膜层致密性较差。在DO为8.0 mg/kg的海水中,11 d相位角图呈现明显的两个相位角峰,试样表面形成了两层膜;11~19 d高频区的相位角峰值逐渐减小,试样表面膜层稳定性变差,膜层进入波动溶解状态。在DO为14.0 mg/kg的海水中,在1 d时就形成了两个相位角峰,保护膜形成较快;5~11 d后,相位角峰转变为一个,试样表面膜层进入波动溶解阶段;11~19 d再次出现两个相位角峰且随时间增长峰值略有增大,但并不明显,此时试样表面膜层仍在形成,但已基本形成了致密稳定的膜层。
图3为B30铜镍合金在海水中电化学阻抗拟合的等效电路图。Rs是溶液电阻,Rct是电极反应的电荷转移电阻,Rct值可以反映试样表面发生反应的难易程度;Rf为膜电阻;CPEf由膜电容Cf和弥散指数nf组成,CPEdl由双电层电容Cdl和弥散指数ndl组成,由nf的值可以得出试样表面保护膜的完整性,当nf趋近于1时,保护膜趋于完整。
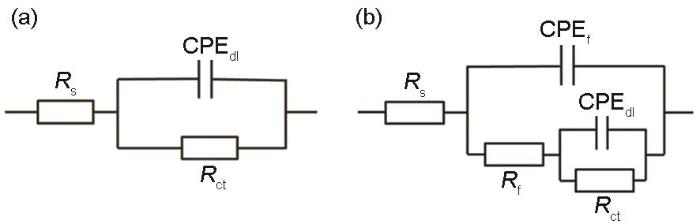
图3 B30铜镍合金在海水中电化学阻抗拟合等效电路图
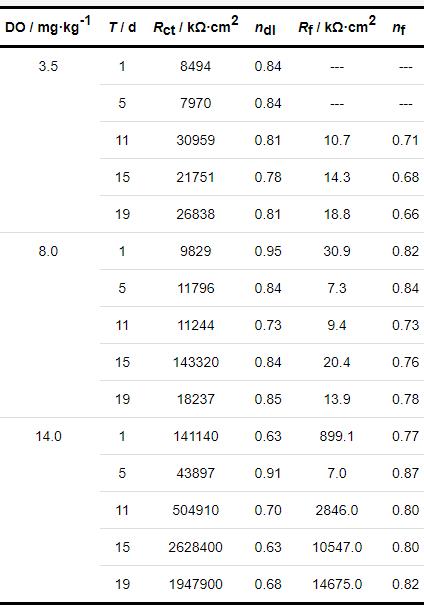
将B30铜镍合金在不同溶解氧浓度海水中EIS用图3a和3b所示等效电路拟合,拟合数据呈现于表1。由Rf值可见,在DO为8.0和14.0 mg/kg的海水中,1 d时试样表面开始成膜,在DO为3.5 mg/kg的海水中,浸泡5 d后还未成膜。整体来看在DO为14.0 mg/kg的海水中,Rf明显大于DO为3.5和8.0 mg/kg的海水,膜层质量更高。溶解氧浓度增高,使得OH-浓度的增加,影响了试样的阳极溶解过程,从而成膜更快且保护性更强。由nf值可以看出,除在DO为14.0 mg/kg海水中浸泡1 d数据外,相同天数不同溶解氧浓度海水中的nf值为:14.0 mg/kg>8.0 mg/kg>3.5 mg/kg,随着溶解氧浓度的提高,试样表面膜层越发完整。由Rct值可以看出,DO为14.0 mg/kg海水中的Rct明显高于DO为3.5和8.0 mg/kg的海水中的Rct,这是由于试样表面膜层的逐渐形成影响了试样的阳极溶解过程,从而使Rct增大,这点与Rf、nf的拟合数据相吻合。
表1 B30铜镍合金不同溶解氧浓度的海水中电化学阻抗拟合数据
XPS能够表征试样表面膜层的成分,判断膜层是否具有保护性。表2为B30铜镍合金在不同溶解氧浓度海水中的XPS图拟合结果。由Cu谱的拟合数据可以看出,随着溶解氧浓度的提高,表面膜层中Cu2O和CuCl所占的比例显著提高,CuO和CuCl2的含量则呈现降低的趋势。
表2 B30铜镍合金在不同溶解氧浓度海水中的XPS图拟合结果
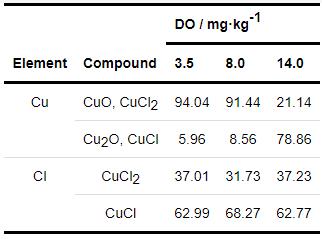
B30铜镍合金在海水环境中成膜,其反应过程已经有了一定的研究[22,23],试样表面会先形成CuCl盐膜 (反应2),CuCl可与Cl-进一步螯合生成可溶性的CuCl2- (反应3),溶解的CuCl2-继续发生沉积反应,形成Cu2O膜 (反应4)。Cu2O是一种半导体,合金元素Ni可以通过占据Cu2O中的阳离子空穴或替代铜离子掺杂到有缺陷的Cu2O点阵中去,提高膜的耐蚀性[24-27],增强了膜层与基体的结合能力[20]。随着浸泡时间的增加,Cu2O会进一步发生反应生成CuO、Cu2(OH)3Cl等保护性较差的腐蚀产物 (反应5、6)。结合表3数据,由此可以看出,随着溶解氧浓度的提高,Cu2O和CuCl所占的比例提高,试样表面膜层更具保护性。
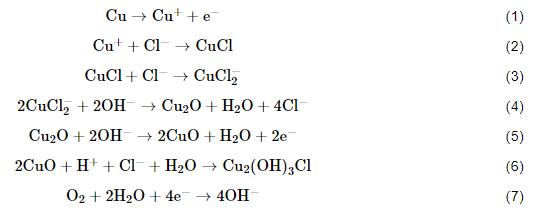
表3 B30铜镍合金在不同流速海水中的电化学阻抗拟合数据
海水中溶解氧浓度的增大会加快成膜反应中阴极氧的去极化反应 (反应7),使得OH-浓度的增加,进而影响阳极反应过程 (反应5、6),使得CuO和Cu2O的含量可以持续提高,试样表面膜层逐渐增厚。膜层的增厚会在一定程度上影响Cl-、OH-等离子的渗透,影响膜层的进一步形成,从而影响阳极反应的进行 (反应3、4、5),已经形成的CuCl盐膜较难进一步生成CuO和Cu2O,从而导致在DO为8.0 mg/kg的海水中CuCl的含量有一定的提升。当溶解氧浓度提高到14.0 mg/kg时,阴极氧的去极化反应增强,从而使OH-浓度显著增大。渗透进膜层内部的离子进一步增多,阳极过程得以继续,膜层持续增厚,这也导致膜层中的CuCl可以持续发生转化,因此CuCl所占的比例并没有出现同DO为8.0 mg/kg的海水中一般有所提升的现象。在膜层内层Cu2O致密,不易发生脱落,但外层的CuO由于其疏松的性质,持续增厚后会出现脱落的现象,所以Cu2O所占比例明显增多,使得膜层的保护效果增强。
图4为B30铜镍合金在不同溶解氧浓度海水中浸泡20 d的SEM图。由图可见,在DO为3.5和8.0 mg/kg的海水中,试样表面覆盖一层疏松多孔的膜层。在DO为14.0 mg/kg的海水中,试样表面形成的膜层与其他两种溶解氧浓度海水中的明显不同,膜层更加致密,膜层更具保护性,这点与电化学阻抗的拟合数据相符。根据反应 (4) 和 (5) 可知,试样表面形成的疏松多孔的物质主要为CuO和Cu2(OH)3Cl。而在DO为14.0 mg/kg的海水中,形成的较为致密的膜层主要为CuCl以及Cu2O,这一点与XPS分析结果相吻合。

图4 B30铜镍合金在不同溶解氧浓度海水中浸泡20 d的SEM图
2.2 海水的流速对成膜的影响
海水的流速能够改变试样周围的环境和表面的状态,对于B30铜镍合金的成膜具有重要影响,因此研究流速对于成膜的影响十分重要[28]。图5为B30铜镍合金在不同流速海水中的开路电位。由图5可见,试样在不同流速海水中的开路电位均先发生负移,腐蚀倾向逐渐增大。随着试样表面膜层的形成,阻碍了阳极溶解过程,开路电位开始正移,腐蚀倾向减小[29]。在流速为0.8和2.0 m/s的流动海水中,开路电位在1 d开始正移,而在0 m/s海水中,开路电位在5 d时才发生正移,说明在流动的海水中,试样表面能够较快的形成具有保护性的膜层。当流速为0.8 m/s时,开路电位一直处于一个较为稳定的状态,腐蚀倾向变化不大,表面形成的膜层保护性强。流速为2.0 m/s的海水中,在3 d后出现开路电位负移的状况,接着出现产生波动,并在9 d左右腐蚀倾向会超过0 m/s的海水,说明在流速2.0 m/s的海水中,试样表面膜层的完整性和致密性受到影响。
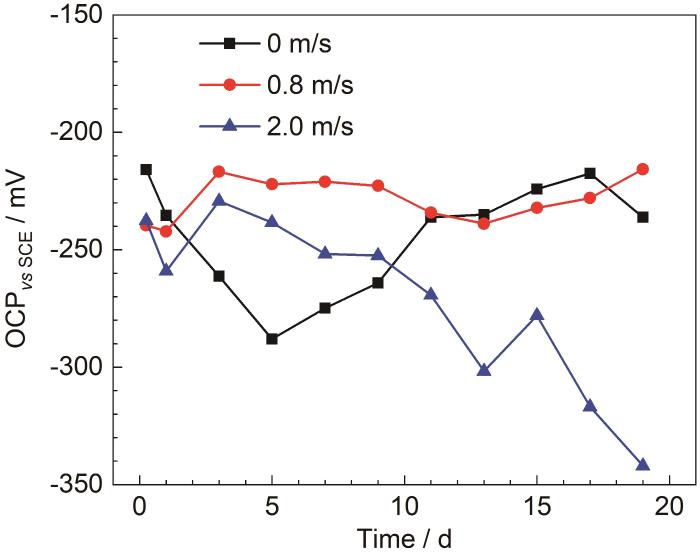
图5 B30铜镍合金在不同流速海水中的开路电位
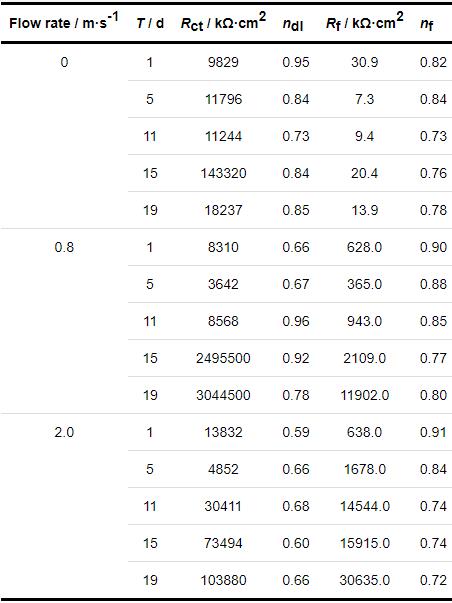
图6为B30铜镍合金在不同流速海水中的EIS图。由Nyquist图可见,各流速海水中容抗弧均处于波动增长的状态,15 d后流速为0.8 m/s的海水比0 m/s海水的容抗弧半径更大,阻抗值变大,说明一定的流速有利于致密膜层的形成。流速为0.8 m/s的海水与2.0 m/s的海水中B30铜镍合金的容抗弧半径在11 d前数值相近,但11 d后0.8 m/s的海水中容抗弧半径更大。在0.8 m/s的海水中,Nyquist图在11 d时产生一个感抗弧,这是由于溶液中大量的Cl-、OH-等侵蚀性离子在电极表面大量聚集,由于这种现象,加速了内层致密膜层的形成,因此B30铜镍合金在0.8 m/s的海水中形成了比在2.0 m/s的海水中更具保护性的膜层。上述数据证明海水的流速对B30铜镍合金表面形成的保护有一定影响且有一个临界值[30],一定的流速有利于致密膜层的形成,但流速过大时,却不利于表面膜层的稳定。
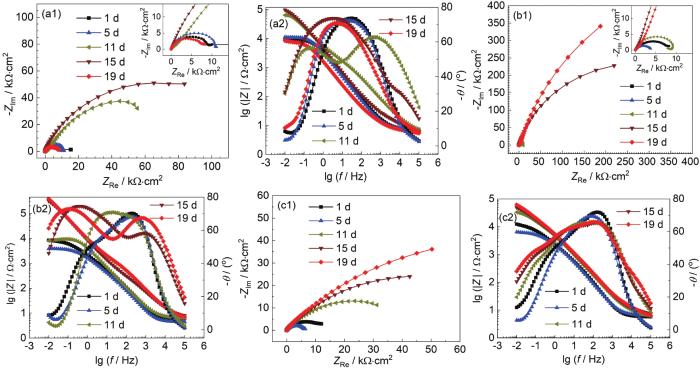
图6 B30铜镍合金在不同流速海水中的EIS图
由Bode图中低频区的模值大小可知不同流速海水中表面膜阻抗值的大小:0.8 m/s>2.0 m/s>0 m/s。由相位角可见,在流速为0 m/s的海水中,11 d开始出现两个相位角峰。11~19 d低频区的相位角峰峰值增大,但高频区的相位角峰峰值减小,说明在流速为0 m/s的海水中试样表面形成的膜层致密性较差且不稳定。流速为0.8 m/s的海水相较流速为0 m/s的海水中,1 d时相位角峰位置向高频区偏移,试样表面开始形成致密的膜层。11~19 d出现两个相位角峰,高频区的相位角峰持续向高频区移动,膜层的致密性提高,低频区出现明显的相位角峰,初期形成的致密膜层外部覆盖疏松的物质,形成两层膜[31-33]。流速为2.0 m/s的海水中,相位角峰同样在1 d时向高频区移动,这说明高致密性的保护膜已经形成,随时间延长,高频区的相位角峰未向高频区移动,但相位角峰值上下波动,膜层的完整性受到影响,低频区出现微弱的相位角峰且不稳定,试样表面覆盖的疏松性的物质无法在该流速下稳定存在[34]。
采用图3b所示等效电路对B30铜镍合金在不同流速海水中的EIS进行拟合,拟合结果呈现于表3。由Rf值可见,在流速为0.8和2.0 m/s的海水中,Rf值明显大于在0 m/s的海水,且有着数量级上的差异。这是由于流动的海水中,能为试样表面源源不断的提供溶解氧,成膜过程中形成Cu2O的步骤 (反应5) 能够不断进行,使得膜层不断完善。在2.0 m/s的海水中,B30铜镍合金的Rf值略大于0.8 m/s的海水中的Rf,这是说明随着流速的增大,试样表面膜层的致密性或者完整性有所提升。由nf值拟合数据可知,在0.8 m/s的海水中,试样表面膜层的完整性最好,这也就证明了流速为2.0 m/s的海水中,Rf值略大于0.8 m/s的海水的原因是由于膜层的致密性有一定的提高。由Rct值可知,在流动的海水中,Rct值后期能够保持稳定,但在流速为0 m/s的海水体系中,Rct值在15 d后急剧下降。这是由于在成膜的过程中,试样周围溶解氧消耗,从而导致生成Cu2O过程缓慢[35],且疏松的CuCl盐膜堆积,直至发生脱落,对阳极溶解的阻碍作用降低,从而导致Rct值减小。15~19 d,在0.8 m/s的海水中的Rct值与其他两种流速海水中相差较大,这说明在该流速下试样表面形成的膜层较其他两种流速更好。
结合表1和表3数据分析流速与溶解氧之间的关系。对比试样在流速为0.8 m/s的海水以及DO为14.0 mg/kg的海水中的成膜,可以看出试样在这两种情况下的电化学阻抗的拟合数据相似,Rct值相对其他情况都有着数量级的差异,由此可见,流动的海水主要是通过改变试样周围介质溶液的溶解氧浓度来影响成膜。由Rf值可知,流速为0.8 m/s的海水中试样的成膜较DO为14.0 mg/kg的海水中的成膜慢,推测可能流速的增大还会对试样表面的成膜产生其他影响。
表4为B30铜镍合金在不同流速海水中的Cu谱和Cl谱拟合数据,由Cu谱的拟合数据可以看出B30铜镍合金在流速为0.8和2.0 m/s的海水中Cu2O和CuCl所占的比例明显高于0 m/s的海水中所占的比例,且流速为2.0 m/s的海水中Cu2O和CuCl所占的比例也比0.8 m/s所占的比例略高,因此流速为2.0 m/s的海水比流速为0.8 m/s的海水中形成的膜层更具保护性,这点与电化学阻抗拟合数据中的Rf值的变化相符。由Cl谱的拟合数据可以看出,在流动的海水中,CuCl的含量较低,这是由于流动的海水可以使试样周围一直保持较高的溶解氧浓度,从而一定程度加速了CuCl水解成为Cu2O的过程。
表4 B30铜镍合金在不同流速海水中的XPS拟合结果
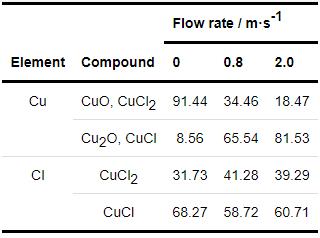
结合表2与表4数据分析流速和溶解氧之间关系。由表4可以看出在流动的海水中Cu2O和CuCl所占的比例与DO为14.0 mg/kg (表2) 海水中Cu2O和CuCl所占的比例类似,因此在流动的海水中试样表面溶解氧浓度的改变是影响成膜的一个主要因素,此结果与电化学阻抗数据相符。在流速为2.0 m/s的海水中,试样表面膜层中Cu2O和CuCl的含量高于流速为0.8 m/s的海水中,也高于在DO为14.0 mg/kg的海水,由此可见,流速的增加除了为试样表面提供溶解氧外还会对形成的膜层的表面状态产生影响。
图7为B30铜镍合金在不同流速海水中浸泡20 d的SEM图。由图可见,相较0 m/s的海水,0.8 m/s的海水中成膜更加致密完整。当流速达到2.0 m/s时,试样的表面产生了冲刷作用,从而使表面膜层发生破裂,因此B30铜镍合金在流速为2.0 m/s的海水中相比0.8 m/s成膜质量下降,这也与表3所示的不同流速海水下的电化学阻抗拟合数据中nf值的变化相符。流动的海水会对试样表面产生冲刷作用,这也导致在DO为14.0 mg/kg的静止海水中11 d左右就形成了较为致密的膜层,而在流速为0.8 m/s的海水中在15 d左右才形成了致密的膜层。
图7 B30铜镍合金在不同流速海水中浸泡20 d的SEM图
流动的海水主要通过改变试样周围海水中的溶解氧浓度来促进其膜层的形成,但其产生的冲刷作用会破坏其膜层的完整性。由表3 B30铜镍合金不同流速海水中的电化学阻抗的拟合数据可以看出,流速即使达到2.0 m/s,B30铜镍合金表面形成的膜层的有效性仍然大于在0 m/s的海水中,这说明在流速低于2.0 m/s时,海水流动导致的溶解氧浓度提高对试样成膜的正向作用仍然大于其冲刷腐蚀对于试样表面膜层的破坏作用,由此可知试样周围介质溶液中的溶解氧浓度的改变是影响成膜的最主要的因素。
3 结论
(1) 海水的溶解氧浓度和流速对B30铜镍合金的成膜影响明显,随着溶解氧浓度的提高,形成的膜层更加致密;随着流速的提高,表面膜层的质量呈现先变好再变差的趋势,在0.8 m/s的低流速海水中更易形成致密完整的膜层。
(2) 流速主要通过改变B30铜镍合金周围海水的溶解氧浓度以及海水流动产生的冲刷作用来影响材料表面致密完整膜层的形成;且在流速低于2.0 m/s的海水中,合金周围海水中溶解氧浓度的改变在成膜过程中占据主导作用。
参考文献
1 Shi Z Y, Liu B, Liu Y, et al. Progress of corrosion behavior and anti-corrosion technology for typical copper-nickel alloys under marine environment [J]. Equip. Environ. Eng., 2020, 17(8): 38
1 石泽耀, 刘斌, 刘岩 等. 典型铜镍合金在海洋环境中腐蚀行为与防护技术研究进展 [J]. 装备环境工程, 2020, 17(8): 38
2 Zhu X L, Lin L Y, Lei T Q. Process of formation of corrosion films on alloy 70Cu-30Ni in seawater [J]. Acta Metall. Sin., 1997, 33: 1256
2 朱小龙, 林乐耘, 雷廷权. 70Cu-30Ni合金海水腐蚀产物膜形成过程 [J]. 金属学报, 1997, 33: 1256
3 Li Y X, Ives M B, Coley K S, et al. Corrosion of nickel-containing stainless steel in concentrated sulphuric acid [J]. Corros. Sci., 2004, 46: 1969
doi: 10.1016/j.corsci.2003.10.017
4 Glover T J. Copper-Nickel alloy for the construction of ship and boat hulls [J]. Br. Corros. J., 1982, 17: 155
doi: 10.1179/000705982798274228
5 Alfantazi A M, Ahmed T M, Tromans D. Corrosion behavior of copper alloys in chloride media [J]. Mater. Des., 2009, 30: 2425
doi: 10.1016/j.matdes.2008.10.015
6 Lin L Y, Liu S F, Zhu X L. Seawater-corrosion-induced intergranular precipitation in Cu-Ni alloy [J]. J. Chin. Soc. Corros. Prot., 1997, 17: 1
6 林乐耘, 刘少峰, 朱小龙. 海水腐蚀导致铜镍合金的沿晶析出 [J]. 中国腐蚀与防护学报, 1997, 17: 1
7 Shen H, Gao F, Zhang G G, et al. Material selection and anti-corrosion measures of seawater piping in warship [J]. Ship Eng., 2002, 32(4): 43
7 沈宏, 高峰, 张关根 等. 舰船海水管系选材及防腐对策 [J]. 船舶工程, 2002, 32(4): 43
8 Ravindranath K, Tanoli N, Gopal H. Failure investigation of brass heat exchanger tube [J]. Eng. Fail. Anal., 2012, 26: 332
doi: 10.1016/j.engfailanal.2012.07.018
9 Yan Y M, Lin L Y, Zhu X L. Effect of residual stress on corrosion resistance of copper tube BFe30-1-1 in 3.5%NaCl [J]. J. Chin. Soc. Corros. Prot., 1994, 14: 59
9 严宇民, 林乐耘, 朱小龙. 残余应力对BFe30-1-1铜管耐蚀性能的影响 [J]. 中国腐蚀与防护学报, 1994, 14: 59
10 Admiraal L, Ijsseling F P, Kolster B H, et al. Influence of temperature on corrosion product film formation on CuNi10Fe in the low temperature range: part 2: Studies on corrosion product film formation and properties in relation to microstructure and iron content [J]. Br. Corros. J., 1986, 21: 33
doi: 10.1179/000705986798272451
11 Hack H P. Role of the corrosion product film in the corrosion protection Cu-Ni alloys in saltwater [D]. State College: Pennsylvania State University, 1987
12 Zhang Z, Yao L A, Gan F X. Effect of surface film on electrochemical behavior of Cu-Ni alloy [J]. J. Chin. Soc. Corros. Prot., 1987, 7: 143
12 张哲, 姚禄安, 甘复兴. 铜镍合金表面膜对其电化学行为的影响 [J]. 中国腐蚀与防护学报, 1987, 7: 143
13 Bai M M, Bai Z H, Jiang L, et al. Corrosion behavior of H62 brass alloy/TC4 titanium alloy welded specimens [J]. J. Chin. Soc. Corros. Prot., 2020, 40: 159
13 白苗苗, 白子恒, 蒋立 等. H62黄铜/TC4钛合金焊接件腐蚀行为研究 [J]. 中国腐蚀与防护学报, 2020, 40: 159
14 Ma A L, Jiang S L, Zheng Y G, et al. Corrosion product film formed on the 90/10 copper-nickel tube in natural seawater: composition/structure and formation mechanism [J]. Corros. Sci., 2015, 91: 245
doi: 10.1016/j.corsci.2014.11.028
15 Syrett B C, Macdonald D D, Wing S S. Corrosion of copper-nickel alloys in sea water polluted with sulfide and sulfide oxidation products [J]. Corrosion, 1979, 35: 409
doi: 10.5006/0010-9312-35.9.409
16 Wang Y Z, Beccaria A M, Poggi G. The effect of temperature on the corrosion behaviour of a 70/30 Cu-Ni commercial alloy in seawater [J]. Corros. Sci., 1994, 36: 1277
doi: 10.1016/0010-938X(94)90181-3
17 Yang F, Zheng Y G, Yao Z M, et al. Study on erosion-corrosion behavior of Cu-Ni alloy BFe30-1-1 in flowing artificial seawater [J]. J. Chin. Soc. Corros. Prot., 1999, 19: 16
17 杨帆, 郑玉贵, 姚治铭 等. 铜镍合金BFe30-1-1在流动人工海水中的腐蚀行为 [J]. 中国腐蚀与防护学报, 1999, 19: 16
18 Wang J H, Jiang X X, Li S Z. Microstructure and corrosion behavior of 70Cu-30Ni welded pipe [J]. Trans. Nonferrous Met. Soc. China, 1995, 5: 88
19 Macdonald D D, Syrett B C, Wing S S. The corrosion of copper-nickel alloys 706 and 715 in flowing sea water. I-effect of oxygen [J]. Corrosion, 1978, 34: 289
doi: 10.5006/0010-9312-34.9.289
20 Ekerenam O O, Ma A L, Zheng Y G, et al. Evolution of the corrosion product film and its effect on the erosion-corrosion behavior of two commercial 90Cu-10Ni tubes in seawater [J]. Acta Metall. Sin. (Engl. Lett.), 2018, 31: 1148
doi: 10.1007/s40195-018-0745-1
21 Chi C Y, Li N, Xue J J, et al. Electrochemical behavior of B30 Cu-Ni alloy in seawater [J]. Mater. Prot., 2009, 42(8): 19
21 迟长云, 李宁, 薛建军 等. B30铜镍合金在海水中的电化学行为 [J]. 材料保护, 2009, 42(8): 19
22 Milo?ev I, Kova?evi? N, Kova? J, et al. The roles of mercapto, benzene and methyl groups in the corrosion inhibition of imidazoles on copper: I. Experimental characterization [J]. Corros. Sci., 2015, 98: 107
doi: 10.1016/j.corsci.2015.05.006
23 Aben T, Tromans D. Anodic polarization behavior of copper in aqueous bromide and bromide/benzotriazole solutions [J]. J. Electrochem. Soc., 1995, 142: 398
doi: 10.1149/1.2044031
24 North R F, Pryor M J. The nature of protective films formed on a Cu-Fe alloy [J]. Corros. Sci., 1969, 9: 509
doi: 10.1016/0010-938X(69)90021-3
25 Feng L, Wang Y H, Zhong L, et al. Influence of short-term storage on corrosion behavior of copper [J]. J. Chin. Soc. Corros. Prot., 2016, 36: 375
25 冯林, 王燕华, 钟莲 等. 短期贮存对金属铜腐蚀电化学行为的影响 [J]. 中国腐蚀与防护学报, 2016, 36: 375
26 North R F, Pryor M J. The influence of corrosion product structure on the corrosion rate of Cu-Ni alloys [J]. Corros. Sci., 1970, 10: 297
doi: 10.1016/S0010-938X(70)80022-1
27 Wang J M, Yang H D, Du M, et al. Corrosion of B10 Cu-Ni alloy in seawater polluted by high concentration of NH4 + [J]. J. Chin. Soc. Corros. Prot., 2021, 41: 609
27 王家明, 杨昊东, 杜敏 等. B10铜镍合金在高浓度NH4 +污染海水中腐蚀研究 [J]. 中国腐蚀与防护学报, 2021, 41: 609
28 Wang G Y, Wang H J, Li X L, et al. Corrosion and Protection of Natural Environment [M]. Beijing: Chemical Industry Press, 1997
28 王光雍, 王海江, 李兴濂 等. 自然环境的腐蚀与防护: 大气·海水·土壤 [M]. 北京: 化学工业出版社, 1997
29 Ding G Q, Li X Y, Zhang B, et al. Variation of free corrosion potential of several metallic materials in natural seawater [J]. J. Chin. Soc. Corros. Prot., 2019, 39: 543
29 丁国清, 李向阳, 张波 等. 金属材料在天然海水中的腐蚀电位及其变化规律 [J]. 中国腐蚀与防护学报, 2019, 39: 543
30 Fang Z G, Liu B. Corrosion and Protection of Submarine Structures [M]. Beijing: National Defense Industry Press, 2017
30 方志刚, 刘斌. 潜艇结构腐蚀防护 [M]. 北京: 国防工业出版社, 2017
31 Yuan S J, Pehkonen S O. Surface characterization and corrosion behavior of 70/30 Cu-Ni alloy in pristine and sulfide-containing simulated seawater [J]. Corros. Sci., 2007, 49: 1276
doi: 10.1016/j.corsci.2006.07.003
32 Kato C, Pickering H W. A rotating disk study of the corrosion behavior of Cu-9.4Ni-1.7Fe alloy in air-saturated aqueous NaCl solution [J]. J. Electrochem. Soc., 1984, 131: 1219
doi: 10.1149/1.2115791
33 Chauhan P K, Gadiyar H S. An xps study of the corrosion of Cu-10Ni alloy in unpolluted and polluted sea-water; the effect of FeSO4 addition [J]. Corros. Sci., 1985, 25: 55
doi: 10.1016/0010-938X(85)90088-5
34 Chang Q P, Chen Y Y, Song F, et al. Corrosion properties of B30 Cu-Ni alloy and 316L stainless steel in a heat pump system [J]. J. Chin. Soc. Corros. Prot., 2014, 34: 544
34 常钦鹏, 陈友媛, 宋芳 等. B30铜镍合金和316L不锈钢在热泵系统中的耐腐蚀性能 [J]. 中国腐蚀与防护学报, 2014, 34: 544
35 Badaw W A, Ismail K M, Fathi A M. Effect of Ni content on the corrosion behavior of Cu-Ni alloys in neutral chloride solutions [J]. Electrochim. Acta, 2005, 50: 3603
doi: 10.1016/j.electacta.2004.12.030
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414






