金属的腐蚀速度与极化作用
文/林玉珍·北京化工大学
在实际中,人们不仅关心金属设备和材料的腐蚀倾向,更重要的是关心腐蚀过程进行的速度。一个大的腐蚀倾向不一定对应着一个高的腐蚀速度。例如铝,从热力学角度看,它的腐蚀倾向很明显,但在某些介质中,它的腐蚀速度却极低,比那些腐蚀倾向较小的金属更耐蚀。可见,腐蚀倾向并不能作为腐蚀速度的尺度。对于金属设备来说,要设法来降低腐蚀反应的速度,以达到延长其使用寿命的目的。为此,必须了解腐蚀过程的机理,掌握不同条件下腐蚀的动力学规律以及影响腐蚀速度的各种因素,并寻求有效地解决方案。
腐蚀原电池
腐蚀发生的根本原因是由于环境中有氧化剂存在。而在工程中“材料/环境”组成的电极系统,由于种种原因(如材料成份等)使金属表面各处的电位不相等,统称为电化学不均匀性,从而形成腐蚀原电池,加速了腐蚀。例如工业锌,因其中含杂质(如Cu),存在着腐蚀电池,所以它的腐蚀速度要比纯锌大的得多如图1所示。
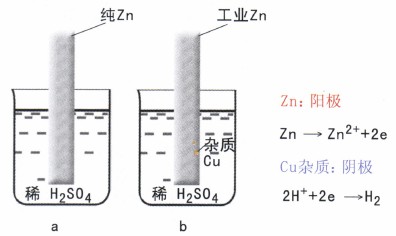
腐蚀电池的工作历程
腐蚀电池的工作原理与—般原电池相同,如图2所示。阳极(区)上发生失去电子的氧化反应(阳极反应),电位相对较低,是电池中的负极,也是发生腐蚀的地方。阴极(区)上发生接收电子的还原反应(阴极反应),电位相对较高,是电池中的正极。腐蚀电流Ic的流向是指正电荷流动的方向,电流从阳极流出进入溶液中,再从溶液中流入阴极。
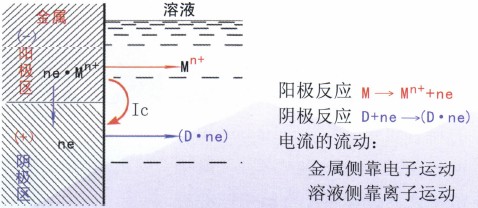
腐蚀电池中,这三部分工作,相互联系,缺—不可。只要其中任何一个步骤停止,整个电池工作就停止,体系中的金属腐蚀也就停止。
腐蚀电池的特点
①腐蚀电池是短路的原电池,它将化学能变成电能,但却不能被利用,而是以热的形式散失掉了。
②腐蚀电池的存在,只能加速腐蚀,而不是腐蚀发生的根本原因。如果环境中没有氧化剂存在,即使有腐蚀电池的存在,也不会发生腐蚀。
③根据腐蚀电池中的电极大小,常把腐蚀电池分为宏观腐蚀电池和微观腐蚀电池两类。
极化作用
极化作用及其表征
观察一个简化的腐蚀电池的工作,如图3所示。
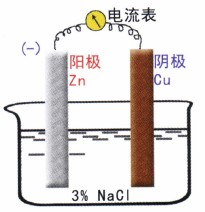
当电池接通的瞬间,可观察到一个很大的起始电流。根据欧姆定律,其电流为:
 式中Ek°为阴极(铜)的开路电位;Ea°为阳极(锌)的开路电位;R为电池系统的总电阻。当电流瞬间达到最大值后,随时间的增长电流却很快减小,最后稳定在一个较小的电流值。
式中Ek°为阴极(铜)的开路电位;Ea°为阳极(锌)的开路电位;R为电池系统的总电阻。当电流瞬间达到最大值后,随时间的增长电流却很快减小,最后稳定在一个较小的电流值。从欧姆定律可知,影响电流强度I的因素有二,电池两极间的电位差和电池内外电阻的总和R。电池接通,总电阻R并没有变化,那么电流I的减小只能是电池两极间的电位差降低的结果。实验测得的情况也完全证明了这一现象。
如图4所示,当电路接通后,阴极(铜)的电位变得越来越负;而阳极(锌)的电位变得越来越正;两极间的电位差变得越来越小,最后当电流减小并稳定在某值时,阴极的电位负移至Ek,而阳极的电位正移至Ea;两极的电位差减小到Ek-Ea,由于Ek-Ea《Ek°-Ea° ,所以在R不变的情况下,I移要比I始小很多。
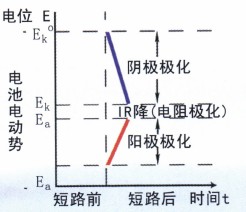
同时,消除或碱弱阳极和阴极极化作用的过程称为去极化作用或去极化过程。能消除或减弱极化作用的物质称为去极化剂。因此,可以认为环境中存在的氧化剂就是—种去极化剂。
可见,腐蚀电池的极化作用,导致腐蚀电流减小,从而降低了腐蚀速度。如果没有极化作用,金属材料和设备的腐蚀速度也将大得多。极化相当于—种阻力,增大极化有利防腐。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。
-
标签: 腐蚀金属极化作用

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414





