不锈钢在Nac1溶液中的“环状”阳极极化曲线如图3所示。
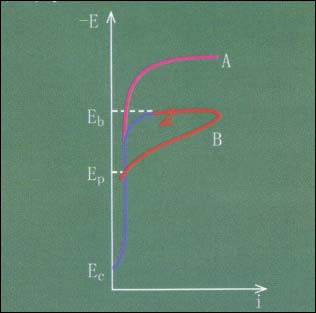
图3 不锈钢在Nacl溶液中的“环状”阳极极化曲线
当溶液中不含C1ˉ时,不锈钢的阳极极化曲线(EcA)中,稳定钝化电位区间较宽。
如果溶液中含C1ˉ,当极化电位升至孔蚀电位Eb(又称击穿电位)时,阳极溶解电流开始显著增大,不锈钢表面产生小孔。当极化电流密度达到预定值后,电位立即以一定速度回扫(BEp),电流再次回到钝态电流密度。此时,钝化膜己重新修复好,再次回到钝化状态,Ep称再钝化电位或保护电位。
可见,氯离子对钝化膜的破坏,只是出现在一定的电位范围内。
当E>Eb时,金属发生孔蚀;当Eb>E>Ep,金属表面已有的蚀孔继续生长,但不再产生新的蚀孔;当E<Ep,金属处于钝态。以此可以衡量不锈钢钝化状态的稳定性以及耐各种介质侵蚀的性能。
但必须注意的是,用动电位法测量时,Ep值与扫描速度有关,而Eb值与回扫的电流密度值有关。所以,只有控制在相同的测试条件下,方可用此法相对比较不锈钢的耐孔蚀能力和再钝化能力。
氯离子破坏钝化的机理
成相膜论者认为,由于氯离子半径小,穿透力强,它最容易透过。膜申极小的孔隙与基体金属相互作用形成可溶性化合物,导致局部腐蚀发生。
吸附论者认为,C1ˉ具有很强的可被金属吸附的能力,而且溶液中的C1ˉ、溶解O2或OHˉ在Fe、Cr等金属表面上存在着竞争吸附,原来被吸附的02可被C1ˉ排代,从而使原来耐蚀性好的钝化膜(金属—氧—羟水合络合物)成为可溶性的络合物(金属—氧—羟—氯络合物),使膜被破坏造成局部腐蚀。
过钝化及其腐蚀
实践证明,金属获得并维持钝态可降低腐蚀。但利用钝性时,必须严格注意防止过钝化引起的腐蚀。
化学钝化中,由于强氧化剂介质的作用,会使金属进入过钝化区,表面将形成可溶性或不稳定的化合物,腐蚀速度重新增大。例如18—8型不锈钢在高浓度硝酸中会形成可溶的高价铬的化合物,发生强烈的过钝化腐蚀。
阳极钝化中,当阳极(被保护设备)电位过高,偏离钝化区进入过钝化区时,同样会出现过钝化腐蚀。例如碳钢在化肥工业的碳化生产液中阳极极化,当电位升高到0.8Ⅴ以上,也同样进入了过钝化区,此时铁被氧化成更高价的,可溶性化合物,使腐蚀加剧。
钝性的利用
金属材料的合金化
金属材料的耐蚀性提高,往往是通过合金化途径,若将某些易钝化的金属,如Ti、A1等和钝化性较弱的金属组成固溶体合金时,可使钢表面易形成钝化膜,显着提高了钢的耐蚀性和其他性能。
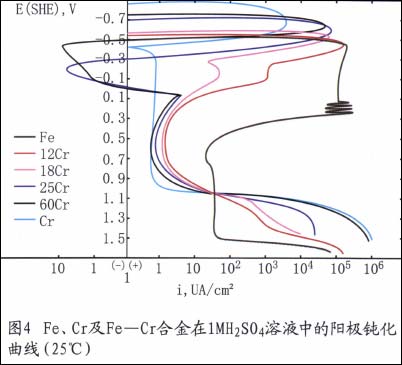
例如,铬是不锈钢获得耐蚀性的最基本元素。在氧化性介质中,铬能使钢表面很快生成Cr203保护膜。这种膜一旦被破坏,会很快修复。在氧化性条仵下,随钢中含铬量的升高,其耐蚀性愈好。如图4所示。
钼也是不锈钢中主要的合金元素,通常添加2%~3%钼时,钢的表面形成富钼氧化物膜。
钼能有效地提高钢的孔蚀电位,可抑制因氯离子侵入而产生的孔蚀。当钼和铬配合使用时,抗孔蚀效果更佳。
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。
-
标签: 金属应用钝化

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414





