吴思思,陈振宇,邱于兵,郭兴蓬*
华中科技大学化学与化工学院,材料化学与服役失效湖北省重点实验室,武汉430074
Email: guoxp@mail.hust.edu.cn
人物简介:
姓名: 郭兴蓬
职务(职称): 教授、博导
邮件: guoxp@mail.hust.edu.cn
学术兼职及参加学会
教育部高等学校材料物理与化学教学指导委员会委员;国家留学基金会评审专家;中国腐蚀与防护学会副理事长、缓蚀剂专业委员会主任委员;中国石油学会腐蚀与防护专业委员会副主任委员;湖北省腐蚀与防护学会副理事长;美国NACE高级会员;日本电化学学会腐蚀专业委员会会员;湖北省化学化工学会理事;腐蚀与防护国家重点实验室学术委员会委员;海洋腐蚀与防护国防重点实验室学术委员会委员;材料化学与服役失效湖北省重点实验室学术委员会副主任。
研究论文
共发表论文150余篇,其中SCI收录论文60余篇。近5年来在国内外学术期刊发表论文90余篇(SCI收录44篇),其中在Electrochimica Acta, Corrosion science, J. the Electrochemical society等国际学术期刊发表论文44篇,在物理化学学报、中国腐蚀与防护学报等国内学术期刊发表论文47篇。

郭兴蓬
摘 要:本文采用十六烷基三甲基溴化铵(CTAB)作为表面活性剂,在除氧和不除氧的胶束水溶液中以铜为基底制备了十二烷基硫醇(DT)自组装膜(SAMs),并用X射线光电子能谱(XPS)和衰减全反射傅里叶变换红外光谱(ATR-FTIR)测定了膜层的结构,用电化学阻抗谱及极化曲线方法对膜层的缓蚀效果进行了评价。结果表明,除氧和未除氧条件下得到的两种膜层整体结构基本一致,且均可有效抑制铜在3% NaCl溶液中的腐蚀反应。由于未除氧条件下组装的膜层中有少量CTAB分子嵌入DT膜层的空隙中,形成的Cu(I)与CTAB复合物填补了DT分子膜层中的缺陷,从而表现出更优异的缓蚀效果。
关键词:胶束水溶液,硫醇,自组装膜,铜,缓蚀行为
近年来,在胶束水溶液中制备自组装膜(Self-assembled Monolayers, SAMs)引起了研究人员的关注[1-6]。与传统有机溶剂中制备的自组装膜相比,水溶液中的组装过程由于存在着碳氢链间的疏水作用,使获得的水生膜层具备更高的致密性和更优良的防护效果[1]。
Yan等[1,2]报道了六乙二醇单十二醚和烷基三甲基溴化铵的胶束水溶液中在金表面修饰烷基硫醇SAMs,认为由胶束辅助形成自组装膜的过程受到以下因素的影响:表面活性剂的选择,胶束的大小和电荷,以及胶束在溶液或基底的相互作用。Ganesh等[3]应用一种六角形感胶液晶相在金表面组装膜层,这种相由一定比例的水,聚乙二醇辛基苯基醚和烷基硫醇组成;发现在表面活性剂水溶液中获得的膜层比二氯甲烷溶剂中获得的膜层有更好的保护性能。García Raya等[4]亦运用感胶液晶相在Au(111)表面组装1,8-辛二硫醇,实验结果显示在不除氧的条件下可短时间制得有效阻碍电子传递的SAMs.Liang等[5]研究了水生十八烷基硫醇保护银抗变色的能力。Wang等[6]在除氧条件下于铜表面制备烷基硫醇SAMs,并发现这种水生膜层与乙醇溶剂中制备的膜层具有相似的优良性能。#p#分页标题#e#
自组装膜被广泛用于铜的腐蚀防护[6-8]。已有的研究工作在组装过程中普遍使用有机溶剂,而这会对环境造成负面影响。此外,最常用的有机溶剂乙醇,被认为对自组装过程产生阻碍,因为乙醇会与铜基底发生相互作用[8]。已有研究表明,在铜表面存在的氧化物薄膜并不影响形成高质量的烷基硫醇自组装膜[8]。因而,在未除氧的胶束水溶液中制备高质量SAMs可作为一种环境友好、易于操作的方式,成为潜在的良好选择。本文研究了在未除氧胶束水溶液中于铜表面制备十二烷基硫醇自组装膜的结构和缓蚀性能,使用的表面活性剂为CTAB.作为对比,相应的在除氧条件下制备的膜层将一并讨论。
1 实验方法
2.1 材料与试剂
十二烷基硫醇(DT,≥ 98.0%)溶于11 mM的十六烷基三甲基溴化铵(分析纯)水溶液中制得1 mM的DT胶束水溶液。3% NaCl水溶液和7 M HNO3水溶液均采用分析纯的试剂和去离子水制备。
直径为5.0 mm 的纯铜试样封装于环氧树脂中作为工作电极。尺寸为5×5×1 mm 的纯铜片用于XPS和ATR-FTIR测试。
1.2 自组装膜的制备
铜样品经过机械抛光和乙醇棉球擦拭后,放入7 MHNO3水溶液中浸蚀30秒,随即用大量去离子水冲洗,然后迅速放入35℃除氧或未除氧的自组装水溶液中4小时。组装结束后,用去离子水冲洗铜表面,并于氮气氛围下干燥。
1.3 测试方法
电化学测试采用CS350电化学工作站,电解液为3% NaCl水溶液,测试在室温下进行,测试开始前体系至少稳定1小时。铂黑电极和饱和甘汞电极(SCE)分别作为辅助电极和参比电极。所有的测试电位都相对于SCE.电化学阻抗谱(EIS)测试的交流幅值为±5 mV,频率范围从100 kHz到1 mHz.运用Zview分析软件,建立合适的等效电路来分析阻抗数据。极化曲线的扫描范围为-0.4 V到+ 0.4 V,扫描速率为0.5 mV/s。
X射线光电子能谱(XPS)采用美国VG公司的Multilab 2000系统,激发源为Mg Kα辐射,键能通过C(1s)主峰284.6 eV校正。衰减全反射傅里叶变换红外光谱(ATR-FTIR)所用设备为德国Bruker公司的Vertex 70光谱仪。谱图的分辨率为2 cm-1,设备在扫描背景256次后,再扫描样品256次。
2 结果与讨论
2.1 XPS分析
图1显示了分别于除氧和未除氧条件下在胶束水溶液中自组装DT后铜表面的XPS.C,Cu和S元素的存在表明在水溶液中DT成功在铜表面吸附。通过比较两种条件下制备膜层的XPS,可观察到两种SAMs的物质种类及其含量的组成并无明显区别。图1中可清楚观察到Cu(2p)的特征峰。Cu L3M45M45的峰位于560和580 eV之间,而在75和123 eV之间的峰对应于Cu(3s)和Cu(3p)。

Figure 1. XPS spectra of DT-covered copper prepared in the aerated and deaerated aqueous micellar solution
图2(a)为S(2p)的峰,形成于未除氧溶液中膜层的相应峰值为162.5 eV,而形成于除氧溶液中膜层的对应峰值为162.4 eV,均为典型的铜硫键Cu-S的键能[9,10]。然而,在未除氧环境中获得SAMs的S(2p)峰相对较宽,这表明可能有少量的硫醇被氧化,或者说明膜层的结构较复杂杂[10]。但由于双硫键―S―S―对应的峰值(约为167 eV)几乎观察不到,故可认为铜放入组装溶液后,有机物会迅速吸附在铜表面,从而即使在不除氧的环境中,铜表面被氧化的程度也很低。键能为530.3 eV的O(1s)峰对应于Cu2O中的氧,而532.2 eV中测得的O(1s)峰源于吸附水中的氧[11,12]。除氧条件下出现的O(1s)峰是由于在制备过程中难以避免地产生了少量的Cu2O或者是引入了物理吸附的污染物[7]。在除氧溶液中形成的SAMs未检测到N(1s)峰。而在约400 eV处存在的两个小峰表明,在未除氧的环境中,有少量的CTAB分子物理吸附在硫醇表面,或者嵌入到DT膜中。
2.2 红外光谱
图3显示了DT覆盖铜表面的红外谱图,各个峰的位置表明碳氢链是以Z字形延伸方式为主的结构[13]。Ron等[8]引入了用于分析SAMs结构的定性参数,即亚甲基对称振动峰νs(CH2)和甲基对称振动峰νs(CH3)的比值,用I(CH2)/I(CH3)表示。通过图3可观察到未除氧环境中获得的膜层有相对更低的I(CH2)/I(CH3),表示SAMs的排列方向更接近于金属表面的法线,从而基底整体上有更好的致密性。

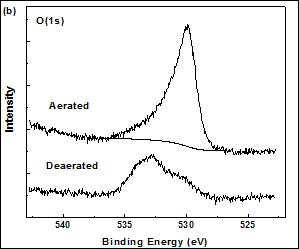
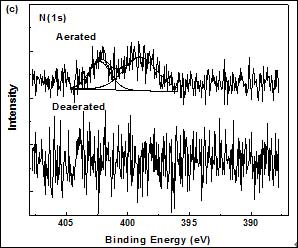
Figure 2. XP high-resolution S(2p), O(1s) and N(1s) spectra of DT-covered copper modified in the aerated and deaerated aqueous micellar solution.
亚甲基不对称振动峰νa(CH2)的波数值可用于分析烷基分子链间的内在环境。未除氧环境中制备膜层νa(CH2) 的波数为2920 cm-1,而除氧环境中制备膜层的相应波数为2918 cm-1。前者不仅波数转移至更高值,峰的宽度也明显增加,说明膜层的结晶度较低[14]。此外,前者的甲基对称振动峰的宽度也增加,表明铜表面SAMs的甲基团均一性较差[14]。#p#分页标题#e#
由于除氧条件下的膜层不存在CTAB分子,因而可推测在经过去离子水冲洗后,CTAB分子不会以平躺或直立的方式物理吸附在DT膜层表面。由于物理吸附的CTAB分子可轻易被化学吸附的DT分子取代[2],故未除氧条件下膜层中存在的CTAB分子应是嵌入在DT膜层的缺陷中。这些嵌入CTAB分子的烷基链比周围环境中的DT分子的烷基链长,从而导致了膜层甲基团排列的不均一。“暴露”的亚甲基团也使得在未除氧条件下膜层的结晶度较差。因此,两种SAMs都拥有良好的致密性和结晶度,红外谱图的差别是由于未除氧环境中制备膜层含有两种不同链长的分子所致。
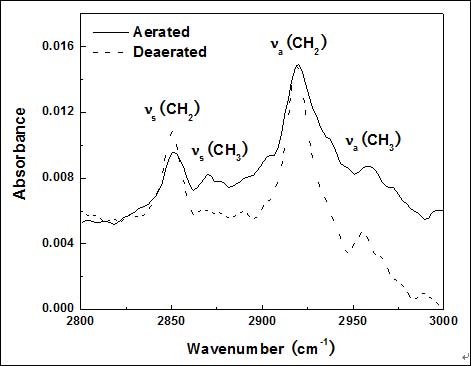
Figure 3. ATR-FTIR spectra of DT-covered copper assembled in the aerated and deaerated aqueous micellar solution
2.3 电化学阻抗谱测量
裸铜电极和分别在未除氧和除氧条件下制备的DT覆盖铜电极(曲线1和2)在3% NaCl溶液中的EIS如图4所示。在NaCl 溶液中,铜的腐蚀反应包括铜的阳极溶解和氧的阴极还原。对于未组装铜电极,Nyquist图可观察到高频的一个小半圆形(容抗弧)以及低频的直线(Warburg阻抗)。高频的半圆是由单时间常数的电荷传递电阻(Rct)和双电层电容所致(Cdl),从半圆的直径可获得Rct值[15,16]。低频部分由铜/溶液界面的传质过程所控制[15,16]。
对于DT覆盖的铜电极,从高频至低频的压扁的大半圆形表明由于铜表面吸附DT,Rct成为主要控制因素。Bode图显示随着频率增加,log|Z|也增加,且斜率接近-1。从相应的相位角图可看出,在很宽的频率范围内,相位角始终保持在较高值。此外,Warburg阻抗消失。以上特征表明,在铜表面吸附的DT膜层十分致密,对铜起到了良好的保护作用。


Figure 4. (a) Nyquist plots, (b) Bode plots and phase angle plots of bare copper electrode and DT-covered (curves 1 to 4) copper electrodes in 3% NaCl solution. 1, SAM formed under aerated condition; 2, SAM formed under deaerated condition; 3, immersion of sample 1 in 3% NaCl solution for 7 days; 4, immersion of sample 2 in 3%NaCl solution for 7 days
EIS结果的模拟等效电路如图5所示,其中Rs为工作电极和参比电极之间的溶液电阻,Rct代表电荷传递电阻,Rsam是SAMs的传递电阻,而W代表着Warburg阻抗。即使是十分致密的膜层,电荷仍然可以侵入[17],因此自组装膜不能作为理想的电容。采用常相位角元件(CPE)代替Cdl来更有效地模拟压扁的半圆形[18]。CPEsam和CPEdl分别代表自组装膜电容和双电层电容。CPE的导纳和阻抗用以下公式表示
YCPE = Y0(jω)n (1)
ZCPE = 1/ Y0(jω)-n (2)
其中Y0表示系数,ω是相位角,n为指数项。表1列出了相应的Rct,Rsam和CPE值。从表中可看出,未除氧环境中获得的膜层有更高的Rsam值和更低的CPE值,表明能更有效地阻碍铜电极表面的氧化还原反应。

Figure 5. Equivalent circuits of (a) bare copper electrode, (b) DT-covered copper electrode and (c) DT-covered copper electrode after 7 day immersion in 3% NaCl solution
图4也显示了膜层在3% NaCl中浸泡7天后的EIS图(曲线3和4),相应的阻抗参数列于表1.由于SAMs长时间浸泡于腐蚀性介质中,Warburg阻抗重新出现,Rsam值减小。CPE增加是由铜表面生成的腐蚀产物所致[19]。此外,log|Z|-log f曲线的斜率已偏离-1。以上现象说明膜层的结构发生了变化。Feng等[7]运用XPS研究了覆盖十二烷基硫醇铜表面在3% NaCl溶液中浸泡1至7天的膜层变化,发现随着浸泡时间的延长,C和S元素的原子百分比几乎没有变化,而氧的含量显着增加,这表明在DT膜层内生成了铜的氧化物。这种结构的变化会使SAMs的结晶度降低。然而,从表1可看出,两种膜层在3% NaCl溶液浸泡7天后,Rsam值仍然较高,而在未除氧环境中形成膜层有更高的Rsam值和更低的CPE值,表明两种膜层均能较好地抑制在腐蚀性介质中的长时间浸泡,且未除氧环境中制备膜层的的缓蚀性能随时间的衰减更小。
在腐蚀性介质中浸泡前后,未除氧条件下制备的SAMs均表现出更优良的防护效果,这是由于嵌入在DT膜层缺陷中的CTAB分子在水溶液中产生的溴离子和季铵盐离子的协同作用对铜产生了保护[20],形成的复合物会沉积在铜的表面形成保护膜[21]。文献中报道的复合物存在形式为CTAB-Cu(Ⅱ)[21],但XPS测试结果表明铜表面并不存在二价铜离子,因而沉积膜是以CTAB-Cu(Ⅰ)的形式存在。由于复合物填补了DT分子间的缺陷,提高了膜层的覆盖度,故在防止铜腐蚀时表现得更优异。#p#分页标题#e#
Table 1. Impedance parameters of bare copper electrode and DT-covered (samples 1 to 4) copper electrodes in 3% NaCl solution
| Sample | Rct (Ω cm2) |
CPEdl (F/cm2) |
Rsam (Ω cm2) |
CPEsam (F/cm2) |
| Blank | 1.43×103 | 1.06×10-3 | - | - |
| 1 | 6.36×103 | 1.37×10-6 | 3.81×105 | 1.19×10-7 |
| 2 | 2.60×104 | 6.85×10-6 | 2.16×105 | 4.74×10-6 |
| 3 | 1.58×104 | 6.26×10-6 | 7.43×104 | 1.41×10-6 |
| 4 | 2.87×104 | 4.86×10-5 | 4.61×104 | 8.11×10-6 |

Figure 6. Polarization curves of bare copper electrode and DT-covered (curves 1 to 4) copper electrodes in 3% NaCl solution
未组装铜电极和DT覆盖铜电极在3% NaCl溶液中的极化曲线如图6所示。使用塔菲尔外推法获得的相应参数列于表2.膜层的存在明显降低了阳极和阴极的极化电流密度,而阴极极化电流密度的降低幅度更为显着。DT覆盖铜电极的阳极溶解峰完全消失(曲线1和2)。组装膜层铜电极的自腐蚀电位相对于空白转移至更负值,这是由于更显着地抑制了阴极反应所致。在未除氧环境中膜层的阴极极化电流密度(icorr)相对空白降低了三个数量级,而除氧环境中膜层的icorr降低了两个数量级。这与EIS测试获得的结论一致。缓蚀效率η可运用以下公式计算[7]:
η = 1-icorr/ i'corr(3)
其中icorr和 i'corr分别代表空白和DT覆盖铜电极的阴极极化电流密度。相应的计算结果已列于表2.在未除氧环境中制备的SAMs缓蚀效率超过了99.9%,表明在不除氧的情况下,能在铜表面制备缓蚀性能更优异的膜层。
在3% NaCl溶液中浸泡7天后膜层的极化曲线及其拟合结果见图6和表2.在腐蚀性介质中长时间浸泡后,阳极溶解峰出现,icorr略有增加,但两种膜层仍维持较高的η。这说明虽然在3% NaCl溶液中浸泡7天后膜层仍保持了很好的保护性能,但膜层的稳定性和保护性已有明显下降。不过,相对于除氧条件,未除氧环境中获得的SAMs的η减小的幅度更低。结合EIS的测试结果,可认为在3% NaCl溶液中浸泡7天后,在未除氧条件下制备的SAMs具备更好的缓蚀能力。
Table 2. Polarization parameters of bare copper electrode and DT-covered copper electrodes in 3% NaCl solution.
| Sample | Ecorr (mV) | Icorr (A/cm2) | PE(%) |
| Blank | -203.6 | 6.14×10-6 | - |
| 1 | -223.3 | 2.95×10-9 | ﹥99.9 |
| 2 | -239.8 | 2.47×10-8 | 99.6 |
| 3 | -264.2 | 2.80×10-7 | 95.4 |
| 4 | -260.5 | 6.89×10-7 | 88.8 |
3 结论
在以CTAB为表面活性剂的DT胶束水溶液中制备的SAMs对铜有优异的保护作用,于腐蚀性介质中长时间浸泡后仍能较好地抑制腐蚀反应的发生,因为这种水生自组装膜致密性高、缺陷少。相对于除氧条件下制备的膜层,未除氧条件下获得的膜层有更优良的整体链密度和更出色的防护能力,且在3% NaCl溶液中浸泡7天后,缓蚀性能的衰减程度更低;这是由DT自组装膜及少量缺陷中形成的CTAB-Cu(Ⅰ)复合物的共同保护所致。
参考文献
[1] Dong Yan, Jeremy A. Saunders, G. Kane Jennings. Enhanced chain densities of n-alkanethiolate self-assembled monolayers on gold from aqueous micellar solutions[J]. Langmuir, 2000, 16(20): 7562-7565.
[2] Dong Yan, Jacob L. Jordan, Vorakan Burapatana, et al. Formation of n-alkanethiolate self-assembled monolayers onto gold in aqueous micellar solutions of n-alkyltrimethylammonium bromides[J]. Langmuir, 2003, 19(8): 3357-3364.
[3] V. Ganesh, Santanu Kumar Pal, Sandeep Kumar, et al. Self-assembled monolayers (SAMs) of alkoxycyanobiphenyl thiols on gold surface using a lyotropic liquid crystalline medium[J]. Electrochimica Acta, 2007, 52(9): 2987-2997.
[4] Daniel García Raya, Rafael Madue?o, Manuel Blázquez, et al. Formation of a 1,8-octanedithiol self-assembled monolayer on Au(111) Prepared in a lyotropic liquid-crystalline medium[J]. Langmuir, 2010, 26(14): 11790-11796.
[5] Chenghao Liang, Changjiang Yang, Naibao Huang. Tarnish protection of silver by octadecanethiol self-assembled monolayers prepared in aqueous micellar solution[J]. Surface and Coating Technology, 2009, 203(8): 1034-1044.
[6] Peng Wang, Chenghao Liang, Bo Wu, et al. Protection of copper corrosion by modification of dodecanethiol self-assembled monolayers prepared in aqueous micellar solutions[J]. Electrochimica Acta, 2010, 55(3): 878-883.#p#分页标题#e#
[7] Yiqi Feng, Wah-Koon Teo, Kok-Siong Siow, et al. Corrosion protection of copper by a self-assembled monolayer of alkanethiol[J]. Journal of The Electrochemical Society, 1997, 144(1): 55-64.
[8] Hannoch Ron, Hagai Cohen, Sophie Matlis, et al. Self-assembled monolayers on oxidized metals. 4. superior n-alkanethiol monolayers on copper[J]. The Journal of Physical Chemistry B, 1998, 102 (49): 9861-9869.
[9] A. Galtayries, J.-P. Bonnelle. XPS and ISS studies on the interaction of H2S with polycrystalline Cu, Cu2O and CuO surfaces[J]. Surface and Interface Analysis, 1995, 23(3): 171-179.
[10] Paul E. Laibinis, George M. Whitesides. Self-assembled monolayers of n-alkanethiolates on copper are barrier films that protect the metal against oxidation by air[J]. Journal of the American Chemical Society, 1992, 114(23): 9022-9028.
[11] C. D. Wagner, J. F. Moulder, L. E. Davis et al. Handbook of X-ray Photoelectron Spectroscopy, Perking-Elmer Corporation, Physical Electronics Division (end of the book), Eden Prarie, MN, 1979.
[12] G. Beamson, D. Briggs. High Resolution XPS of Origanic Polymers. The Scienta ESCA 300 Database, Wiley, Chichester, 1992.
[13] G. Kane Jennings, Jeffrey C. Munro, Tseh-Hwan Yong, et al. Effect of chain length on the protection of copper by n-alkanethiols[J]. Langmuir, 1998, 14(21): 6130-6139.
[14] A. Todd Lusk, G. Kane Jennings. Characterization of self-assembled monolayers formed from sodium s-alkyl thiolsulfates on copper[J]. Langmuir, 2001, 17(25): 7830-7836.
[15] O. E. Barcia, O. R. Mattos, N. Pebere, et al. Mass-transport study for the electrodissolution of copper in 1M hydrochloric acid solution by impedance[J]. Journal of the Electrochemical Society, 1993, 140(10): 2825-2832.
[16] Claude Deslouis, Bernard Tribollet, Guiliano Mengoli, et al. Electrochemical behaviour of copper in neutral aerated chloride solution. I. Steady-state investigation[J]. Journal of Applied Electrochemistry, 1988, 18(3): 374-383.
[17] Tal M. Nahira, Edmond F. Bowdena. Impedance spectroscopy of electroinactive thiolate films adsorbed on gold[J]. Electrochimica Acta, 1994, 39(16): 2347-2352.
[18] Xiaojuan Wu, Houyi Ma, Shenhao Chen, et al. General equivalent circuits for faradaic electrode processes under electrochemical reaction control[J]. Journal of the Electrochemical Society, 1999, 146(5): 1847-1853.
[19] A. Bonnel, F. Dabosi, C. Deslovis, et al. Corrosion study of a carbon steel in neutral chloride solutions by impedance techniques[J]. Journal of the Electrochemical Society, 1983, 130(4): 753-761.
[20] Houyi Ma, Shenhao Chen, Bingsheng Yin, et al. Impedance spectroscopic study of corrosion inhibition of copper by surfactants in the acidic solutions[J]. Corrosion Science, 2003, 45(5): 867-882.
[21] S. Ramesh, S. Rajeswari. Evaluation of inhibitors and biocide on the corrosion control of copper in neutral aqueous environment[J]. Corrosion Science, 2005, 47(1): 151-169.

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62313558-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414




