以中国北方某再生水厂的出水为研究对象,重点围绕特征有机物腐殖酸对铸铁腐蚀的影响开展实验研究,应用X射线衍射、扫描电镜等手段,探讨了再生水中腐殖酸对铸铁腐蚀形貌、腐蚀生长过程及腐蚀形成机制的影响。结果表明,在反应初期,再生水中的腐殖酸与铸铁表面反应形成稳定的吸附膜抑制铸铁表面的腐蚀,随着反应时间的推移,逐渐生长的污垢将吸附膜破坏形成腐蚀,再生水中腐殖酸浓度为6 mg/L时腐蚀速率最小,因此,再生水中腐殖酸浓度过高和过低都不利于腐蚀控制。
再生水回用具有水质水量相对稳定,不受季节影响的特点,是解决水资源短缺现实可行的措施。但是,城市再生水由于原水水质复杂、各处理工艺出水水质差距较大等原因,经膜工艺处理后仍然具有较高的溶解性有机物 (DOM) 含量。其中最主要的组分是腐殖质,约占水中总有机物的60%~90%,其组成较复杂,通常没有固定的结构,一般认为是由一些烷基芳香烃单元、羧基、酚羟基和醌基等官能团组成,可将其分为腐殖酸、富里酸及亲水酸三类。目前,人们研究较多的是腐殖酸和富里酸,常把它们统称为腐殖酸。腐殖酸在水体中通过酚羟基、羧基、醇羟基、羰基、醌基等多种基团可以与有机物进行结合,同时也对许多金属离子具有很强的络合作用,进而影响有机污染物和金属离子在水体中的迁移转化行为,威胁城市的供水安全。Rahman等对溶解性有机物在铸铁管上的吸附进行了研究,研究发现DOM会吸附在铸铁管的腐蚀产物Fe3O4和FeO(OH) 上,同时符合Langmuir吸附等温线,表现为单层吸附,这种吸附能力在pH较低的情况下表现更加明显。崔崇威等在腐殖酸对水源供水安全方面进行了研究,结果表明,腐殖酸易引起水厂出水色度超标,降低生物稳定性,影响给水卫生,是某些地方性疾病的主要环境因素之一。然而,在再生水输配过程中腐殖酸对管道腐蚀影响的研究尚缺乏。为了减缓和防护再生水水质对管道产生的腐蚀作用,保证再生水在输配环节的安全,提高再生水系统的运行可靠性和经济性,开展再生水中腐殖酸对常用金属管材的腐蚀特性研究具有很强的现实意义。
1 实验方法
试验采用铸铁腐蚀挂片 (5 cm×2.5 cm×0.2 cm),材料化学成分 (质量分数,%) 为:C 3.17,Si 1.56,Mn 0.34,P 0.12,S 0.12,Fe余量。再生水取自北方某再生水厂,该再生水厂采用超滤膜处理工艺。
根据再生水水质,利用纯水与NaCl、Na2SO4、Na3PO4配制原水,并加入一定量腐殖酸,用于试验分析。配水水质参数 (mg/L) 为:SiO2 0.3,Cl- 16.7,Ca2+ 30,SO42- 5.5,Na+ 10.1,HCO3- 40,PO43- 0.19,调节其pH值至5.9。本试验所用腐殖酸为商用腐殖酸,将腐殖酸粉末在碱性条件下溶解,将溶液经0.45 μm滤膜过滤,滤后样品作为腐殖酸原溶液,试验过程中所需不同浓度的腐殖酸由高浓度原溶液用蒸馏水稀释而成。
腐蚀挂片试验在旋转反应器中进行,如图1所示。将15片挂片放置在旋转反应器的双层塑料支架上,原水加入反应器,在运行不同时段取出三片挂片,冷冻干燥后一片用于扫描电镜分析,一片用于腐蚀失重分析,一片留存备用。试验分别在2,4,6和8 mg/L 4组不同浓度的腐殖酸下进行,同时进行一组空白试验 (即腐殖酸为0 mg/L)。试验过程中保持间歇进水,每次进水210 mL,进水时间间隔为2 h,水力停留时间为48 h。旋转搅拌器转速稳定在122 r/min,水温控制在20 ℃,pH值控制在6.0左右。
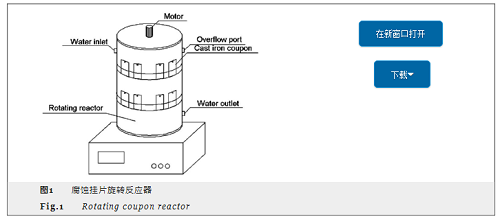
采用Quanta 200 FEG环境扫描显微镜 (SEM) 分析腐蚀挂片形貌。由于腐蚀挂片表面腐蚀产物疏松,在测试之前需进行预处理,用棉签刮去挂片背面的腐蚀产物并用洗耳球进行吹扫,以免在测试时由于掉渣损伤仪器。采用Genesis能谱仪 (EDS) 进行微区元素定量分析。采用X'PERT-PRO MPD X射线衍射仪 (XRD) 分析铸铁挂片表面污垢晶体结构组成,测试条件:CuK辐射、管压40 kV、管流40 mA,采用步进扫描方式,速度为10°/min,步长0.02°。
采用失重法对金属腐蚀情况进行分析,腐蚀速率计算见下式:
![]()
式中,ν为年腐蚀深度,mm/a;m0为腐蚀前挂片的质量,g;m1为经过一段时间的腐蚀并去除表面腐蚀产物后挂片的质量,g;ρ为试验金属材料密度,g/cm3;S为挂片暴露在腐蚀环境中的表面积,m2;t为挂片腐蚀的时间,h。
2 结果与分析
2.1 铸铁腐蚀形貌特征
设置不同腐殖酸浓度,对铸铁挂片分别进行定期取样,用10%HCl+0.5%六次甲基四胺配制的混合液对铸铁挂片进行清洗,洗去铸铁挂片表面污垢及杂质,在自然通风处风干后观察铸铁挂片表面形貌。铸铁挂片表面腐蚀以点蚀开始,随着反应时间的增加,由点蚀不断扩大,形成条状腐蚀区。反应末期,铸铁挂片表面出现粗糙的黑点物质,说明不同反应时间的腐蚀产物也有所不同。通过电镜观察,铸铁表面没有明显的腐蚀区与非腐蚀区,以全面腐蚀为主,如图2a所示。铸铁表面出现两种结构:一种是六棱片结构,如图2b所示;另一种为空心球状结构,如图2c所示。六棱片状腐蚀产物直径约为20~30 μm,结构密实;空心球状腐蚀产物直径约为5~10 μm,空心,壳较厚,结构密实,且球体表面有羽毛状纤维铁氧化物。

张超等采用4个CDC生物膜反应器串联模拟回用水管网,通过控制水力停留时间和搅拌转速来描述不同长度管道在不同流速下的流态,针对铸铁回用水输送管道腐蚀产物的沿程变化特征进行研究。通过对腐蚀产物的微观形态进行分析,模拟回用水铸铁管道沿程腐蚀产物的微观结构由表面存在着微小的颗粒物的疏松多孔结构向表面附着少量丝状物的致密硬壳结构转变。此结果与本研究结果相符合,这种结构致密的腐蚀产物在腐蚀层中的含量较多,有文献报道过类似的铁氧化物,认为是绿锈 (Green rusts) 和纤维铁氧化物。
2.2 铸铁腐蚀产物分析
2.2.1 污垢层结构及其变化
利用SEM对不同浓度的腐殖酸影响下铸铁挂片表面进行观察,同时对污垢微面积进行EDS分析,明确不同形貌污垢的元素组成,了解不同阶段不同腐殖酸浓度影响下铸铁挂片表面污垢的内部结构。根据SEM观察和EDS分析可知,挂片表面污垢层可分为凸起区和非凸起区。随着反应时间的增加,铸铁挂片表面污垢由均匀分布发展成明显的水纹状凸起,挂片表面污垢层厚度不断增大,同时污垢表面结构的剥落和内层结构的生长,表明污垢具有由内向外不断生长的规律。污垢主要以Fe、O和C原子为主。
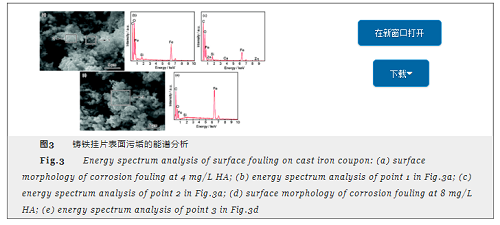
水中无腐殖酸存在时,挂片污垢层凸起区与非凸起区的组成类似,均以铁化合物为主,污垢结构以多孔结构为主。腐殖酸浓度为4和8 mg/L时污垢表面形貌分别如图3a和d所示,标记点1、标记点2、标记点3处污垢的能谱分析分别见图3b,c和e。当腐殖酸浓度为4 mg/L时,随着反应进行,污垢中原子C和原子O的原子分数明显增加,分析可知是由于有机物被吸附在铸铁表面所致。另外,凸起区C原子分数比非凸起区低,说明凸起区的有机物含量比非凸起区低,可能是因为有机物吸附形成的吸附层遭到破坏,污垢层从内部向外扩展,产生凸起。反应后期,凸起区与非凸起区裂缝间出现片状结构污垢,由能谱分析可知,此时O原子分数明显下降,说明此时腐蚀产物可能由γ-FeOOH转化为α-FeOOH[15]。污垢结构以菜花状结构为主。当腐殖酸浓度为8 mg/L时,随着反应进行,C原子分数明显增加,但O原子分数有所下降,挂片表面污垢层凸起区和非凸起区组成结构类似,均以有机物吸附为主,污垢结构以密实排列的球状结构为主。
2.2.2 污垢层相组成及其变化
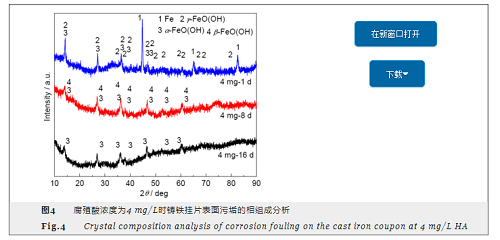
腐殖酸浓度不同时铸铁挂片表面污垢晶体结构分析如图4所示。图4表明,不同浓度腐殖酸对铸铁挂片产生的影响趋势基本一致。以腐殖酸浓度为4 mg/L为例,反应初期,污垢不稳定且组成成分较为复杂,主要以Fe、γ-FeO(OH) 为主。随着反应的进行,腐蚀产物也逐渐发生变化,反应后期主要以α-FeO(OH) 为主。结合扫描电镜分析结果,可以看出在腐蚀反应的进程中,腐蚀产物由Fe2+向γ-FeO(OH) 转化,最终形成了以α-FeO(OH) 为主的污垢主体层。这是由于羟基氧化铁在α-FeO(OH) 晶型时较稳定,其他晶型处于亚稳定状态易于转化成α-FeO(OH)[16]。Sarin等[17]研究铁质供水管道的腐蚀垢层理化结构时发现,腐蚀垢层分为三层:最外层是疏松层,中间是较致密的壳状层,最内层是多孔层。最外层中含有较多的α-FeO(OH),此结果与本试验结果相吻合,这类铁氧化物是由其他稳定性较差的铁氧化物缓慢转变而来的,其对金属的进一步腐蚀有抑制作用,可以减缓腐蚀速率。
2.3 铸铁腐蚀速率分析
反应器内腐殖酸浓度分别为0,2,4,6和8 mg/L,通过腐蚀失重法对各反应器内的铸铁挂片在反应过程中的腐蚀速率进行分析,结果如图5所示。
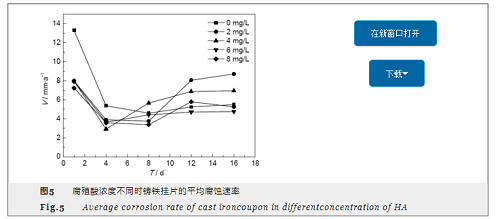
反应器内腐殖酸浓度分别为0,2,4,6和8 mg/L,通过腐蚀失重法对各反应器内的铸铁挂片在反应过程中的腐蚀速率进行分析,结果如图5所示。由图5可知,不同浓度腐殖酸对铸铁挂片的腐蚀速率影响基本遵循先下降后上升的趋势。在无腐殖酸条件下,反应进行1 d时腐蚀速率达到13.3 mm/a,远高于腐殖酸存在的情况,说明在腐蚀反应初期腐殖酸的存在会抑制腐蚀的发生。反应进行到4 d时,腐蚀速率降低,由图4可知,此时铸铁表面逐渐形成较稳定的α-FeO(OH),保护了铸铁内部不受腐蚀,且有腐殖酸存在时,腐蚀速率更低,由图3b,c和e可知,此阶段C、O含量增加,证明铸铁表面被腐殖酸吸附,形成稳定的保护膜,使抑制腐蚀效果更加明显,如腐殖酸浓度为4~8 mg/L时,腐蚀速率为2.9 mm/a,腐殖酸浓度2 mg/L时,腐蚀速率降到3.9 mm/a,说明更高浓度腐殖酸的存在使金属表面形成的保护膜更加致密,抑制效果更强。在反应后期如反应进行到12和16 d,不同腐殖酸浓度所致的铸铁腐蚀速率均有所上升,并逐渐保持稳定,其中,腐殖酸浓度为2 mg/L时腐蚀速率增加最快,16 d时升高至8.7 mm/a,超过腐蚀初期的腐蚀速率 (反应1 d时为7.9 mm/a),说明腐殖酸浓度为2 mg/L时铸铁表面污垢结构很不稳定。反应进行至16 d时,腐殖酸浓度为6 mg/L时腐蚀速率明显较低,说明腐殖酸浓度为6 mg/L时铸铁腐蚀最为稳定且腐蚀速率最小。
综上所述,在反应初期,没有腐殖酸加入的情况下,铸铁表面直接受到来自水体的冲击,发生快速腐蚀。而大量的研究结果[18-21]表明,腐殖酸会通过配位交换、阴离子交换、阳离子架桥、静电力和范德华力等作用吸附在金属氧化物上。腐殖酸中含有的羧基和酚羟基 (—COOH、—OH) 官能团取代铸铁表面的羟基 (—OH)、阴离子和水分子等吸附在铸铁表面,与铁氧化物发生络合反应,在铸铁表面形成稳定的吸附膜,抑制腐蚀的进行。随着反应进行,腐殖酸吸附在铸铁表面的保护膜被破坏,表面污垢结构平衡也失去稳定,腐蚀速率上升。一定浓度的腐殖酸通过吸附-脱附、微生物降解、光解以及生物富集等过程导致管壁中形成异常生物膜,降低管网系统的生物稳定性,进而加速管网腐蚀。在腐殖酸浓度小于6 mg/L时,铸铁腐蚀速率随着浓度的增加而减小,在腐殖酸浓度大于6 mg/L时,铸铁腐蚀速率不降反升,加速铸铁的腐蚀,为控制铸铁腐蚀,腐殖酸浓度宜控制在6 mg/L。
责任编辑:王元
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





