不锈钢厨具在食品和饮料行业的应用有80多年的历史了,不锈钢锅、碗、热水壶等用品深受人们喜爱。然而,当其与食物接触时(尤其是食物烹饪时),不锈钢制品可能腐蚀溶出少量金属离子,当过多摄入这些金属离子时会危害人体的健康,因此厨具不锈钢的安全问题引起了社会各界的广泛关注。
1 、实验方法
1.1实验材料与溶液
实验材料:201型不锈钢
试样尺寸:30mm×20mm
预先处理:其表面用碳化硅水磨砂纸逐级打磨至1000#,然后用丙酮擦洗除油,酒精和蒸馏水清洗,热风吹干备用。
测试介质:
4vol.%HAc溶液
4vol.%HAc+0.4wt.%NaCl溶液
溶液温度:100°C(同时采用冷凝回流器以防止溶液蒸发损失)
溶液体积:100mL
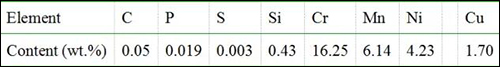
表1 201不锈钢的化学组成
1.2电化学测量
实验采用三电极体系,试样点焊后半浸泡在沸腾溶液中,于1、3、5、7、9、11和13h时进行腐蚀电位与电化学阻抗谱(EIS)测量。
1.3金属元素溶出量测量
将试样完全浸泡于沸腾测试溶液中,当浸泡时间达到1、3、5、7、9、11时更换新的溶液,并分别取0~1h、1~3h、3~5h、5~7h、7~9h、9~11h、11~13h时间段的浸泡液10mL,测量金属元素Fe、Cr、Ni和Mn的溶出量,并计算金属元素在相应时间的溶出速率。
1.4表面分析
取出浸泡13h后的试样,并用蒸馏水清洗、吹干,对试样表面钝化膜进行XPS分析。测量前表面溅射5s以降低污染物的影响。X射线激发源为Al(1486.6eV),用C结合能(284.8eV)对测得的谱峰进行校正,测试结果用XPSPEAK41进行分析。
2、结果与讨论
2.1腐蚀电位与电化学阻抗谱演变特征
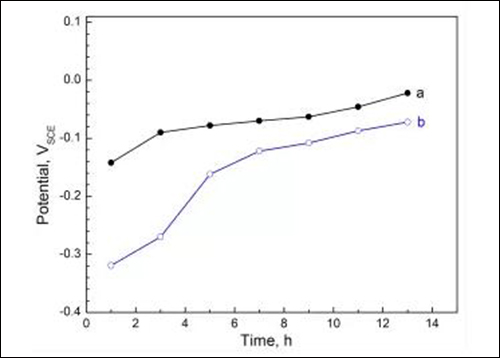
图1 试样在溶液(a)4%HAc和(b)4%HAc+0.4%NaCl 中的腐蚀电位曲线
由图1可知,试样表面在沸腾溶液中均可逐渐形成保护性钝化膜,使得腐蚀电位升高;但是,溶液中添加NaCl会减缓钝化膜的形成与生长,使腐蚀电位达到稳定的时间延长,并导致13h时稳定电位值下降约50mV。
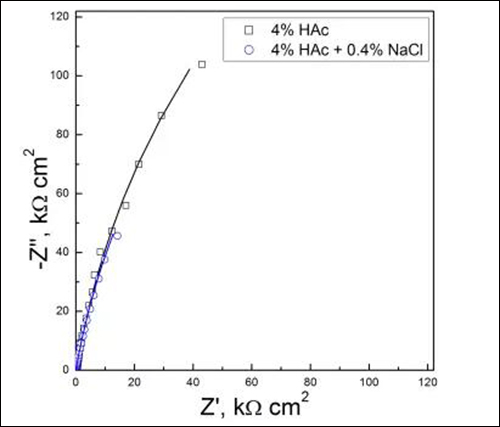
图2 试样在两种溶液中浸泡13h后的电化学阻抗谱
由图2可知,两种溶液中Nyquist图均由一段曲率半径很大的容抗弧组成,并且两条容抗弧几乎重合在一起,说明它们的曲率半径差别较小。由于腐蚀电位与阻抗值均较高,试样表面钝化膜与电荷转移过程的时间常数差别较小,故而两种溶液中阻抗谱均呈现简单容抗特征,可用等效电路Rs(Qf(Rf(QdlRt)))对图2中阻抗谱进行解析。
表2 阻抗参数的拟合数据
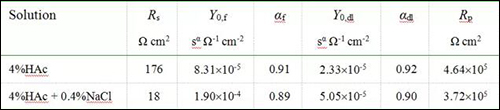
由表2中数据对比分析可获得如下几方面信息:(1)无论溶液中是否引入Cl-,不锈钢试样表面均可形成保护性钝化膜,使得腐蚀阻力Rp值在13h浸泡后高达105Ωcm2,当然Cl-也会使腐蚀阻力降低约20%;(2)沸腾HAc溶液中添加0.4%NaCl会增强溶液的电导率,使得溶液电阻Rs明显降低;(3)溶液中引入Cl-使Y0,f与Y0,dl均变大,即钝化膜和双电层电容均增大,根据点缺陷模型,这主要与钝化膜吸收溶液中的Cl-而导致钝化膜缺陷增多有关。
2.2试样表面钝化膜的XPS分析
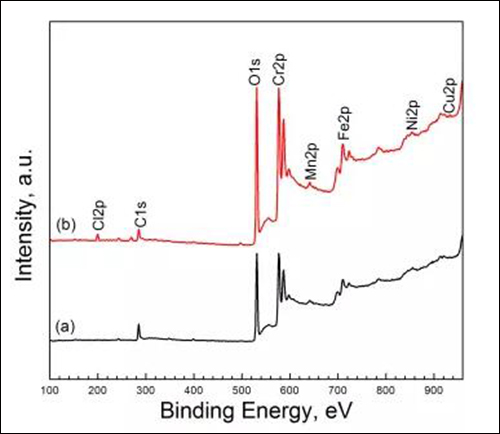
图3两种溶液中浸泡13h后试样表面的XPS宽谱:(a) 4%HAc和(b) 4%HAc + 0.4%NaCl
由图3可知,两种溶液中形成的钝化膜有较强的Fe、Cr、Mn、O和C元素响应峰(其中C来自于污染物),而Ni、Cu元素响应峰十分微弱。Fe和Cr响应峰的组成根据文献可知,钝化膜主要由Fe、Cr的氧化物或/和氢氧化物等物质组成。对于含NaCl的溶液,钝化膜中还检测到Cl元素,说明Cl-被吸收进入了钝化膜。
表3 试样基体及浸泡13h后表面钝化膜的原子数比值
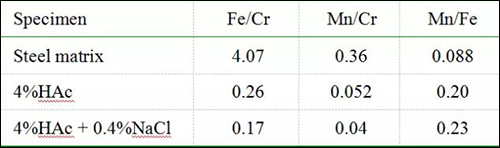
由表3可知,这些数据表明201不锈钢表面的Fe和Mn在沸腾溶液中发生了优先腐蚀而形成了富Cr钝化膜,并且Fe比Mn更易被腐蚀溶解。在4%HAc溶液中添加0.4%NaCl会导致试样表面钝化膜的Fe/Cr和Mn/Cr比值均降低,说明Cl-对不锈钢表面Fe和Mn的腐蚀溶解具有一定程度的加速作用,尤其是Fe因被加速腐蚀而使Mn/Fe比值从0.20略微升高到0.23,这些结果与表2中Rp值的降低(从4.64?105降到3.72?105Ωcm2)相一致。
2.3金属元素的溶出速率
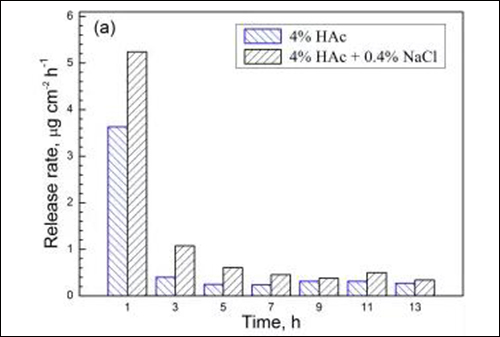
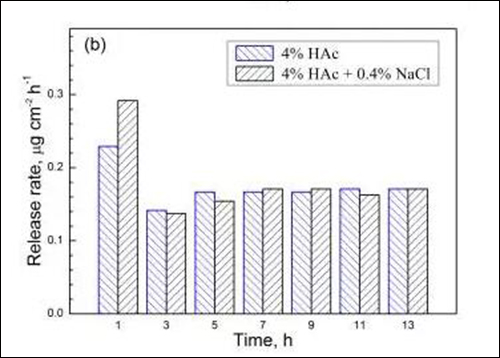
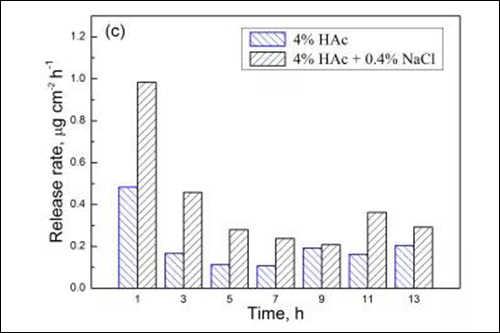
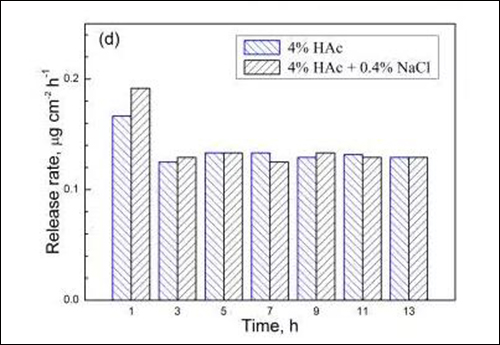
图4 两种溶液中试样在不同浸泡时间的 (a) Fe、(b) Cr、(c) Mn和(d) Ni溶出速率
由于浸泡初期金属元素的溶出速率相对较高,国家标准(GB9684)采用试样在沸腾溶液中浸泡0.5h的溶出量作为指标,规定餐/厨具用不锈钢的Cr与Ni元素溶出量分别小于4和1μgcm-2,Mn元素溶出量尚未明确的限定。从图4可见,201型不锈钢经1h浸泡后,在4%HAc沸腾溶液中的Cr与Ni元素溶出量分别为0.23和0.17μgcm-2,而在4%HAc+0.4%NaCl沸腾溶液中的Cr与Ni元素溶出量为0.29和0.19μgcm-2。由此可知,两种溶液中Cr与Ni元素的溶出量均远小于标准规定值,说明201型不锈钢在食物环境中具有良好耐蚀性。
3、结论
(1)在4%HAc和4%HAc+0.4%NaCl沸腾溶液中,201型Cr-Mn系不锈钢均处于稳定钝化腐蚀状态,其表面能形成保护性富Cr钝化膜,使腐蚀阻力达105Ωcm2。
(2)两种沸腾溶液中,不锈钢的金属元素Fe和Mn在浸泡初期会发生优先腐蚀,其初期溶出速率相对较高,但随浸泡时间延长,腐蚀电位和金属元素的溶出速率均趋于稳定。金属元素的稳定溶出速率从大到小顺序为:Fe>Mn>Cr>Ni,但溶出速率值均很小。
(3)在4%HAc沸腾溶液中添加0.4%NaCl对不锈钢的初期腐蚀具有较大影响,会促进Fe与Mn的腐蚀溶出,导致腐蚀电位下降,但腐蚀进入稳定状态后其影响较小,仅使腐蚀电位和腐蚀阻力轻微下降、Fe与Mn的稳定溶出速率稍有增大,而对Cr与Ni的稳定溶出过程几乎没有影响。
小编建议:
大家最好不要使用不锈钢锅长时间煮沸腾状态的菜品哦,比如煲汤的话还是用砂锅更好~
更多关于材料方面、材料腐蚀控制、材料科普等等方面的国内外最新动态,我们网站会不断更新。希望大家一直关注中国腐蚀与防护网http://www.ecorr.org
责任编辑:王元
《中国腐蚀与防护网电子期刊》征订启事
投稿联系:编辑部
电话:010-62313558-806
邮箱:ecorr_org@163.com
中国腐蚀与防护网官方 QQ群:140808414
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414





