摘要:
选用防锈铝合金3102作为铝空气电池阳极材料,研究有机/无机复合缓蚀剂L-半胱氨酸/ZnO对3102铝合金在4 mol/L NaOH溶液中腐蚀及放电性能的影响。结果表明:复合缓蚀剂明显降低了3102铝合金的自腐蚀速率。在NaOH及NaOH/L-半胱氨酸溶液中,铝阳极溶解由电荷转移控制;而在含ZnO的溶液中,铝阳极的溶解由锌盐及腐蚀产物的扩散控制。在4 mol/L NaOH碱性溶液中添加L-半胱氨酸/ZnO复合缓蚀剂,3102铝合金作为阳极材料的铝空气电池的放电性能明显得到改善。
关键词: 3102铝合金 ; 空气电池 ; 缓蚀剂 ; L-半胱氨酸 ; ZnO
金属空气电池利用空气中的O2作为阴极反应物,降低了电池重量,为电池提供了更大的能量储存空间,具有广阔的发展前景[1]。Al作为金属空气电池的阳极材料具有以下优点:较负的电位 (-1.66 V vs SHE),高的比容量 (2.89 Ah/g) 且储量丰富[2]。但铝空气电池一直没能商业化应用,主要是因为:(1) Al在空气或中性水溶液中表面生成一层保护性钝化膜,这层钝化膜使得铝阳极电位正移而明显降低铝阳极活性[3];(2) 铝空气电池在碱性介质中具有高的理论电势 (2.37 V) 及高的理论能量密度 (8.076 Wh/kg)[4],然而在碱性介质中铝阳极自腐蚀严重,造成了铝阳极极低的阳极利用率[5]。一般常用两种方法降低碱性介质中铝阳极的自腐蚀速率:(1) 在铝合金中添加Sn,In,Ga,Zn等具有高析氢过电位的元素[6,7];(2) 在碱性介质中添加各种缓蚀剂[8,9,10]。
在强碱性介质中铝空气电池放电电流密度高,电池电势高,但铝阳极自腐蚀严重,阳极利用率极低。可以利用在碱性介质中添加缓蚀剂的方法来降低铝阳极自腐蚀速率,常用的缓蚀剂主要分为有机缓蚀剂和无机缓蚀剂,有机缓蚀剂包括聚苯胺、聚丙烯酸、各种醇类等[11,12]。近年来,氨基酸作为绿色缓蚀剂对钢铁、铜等合金的缓蚀作用被广泛研究,而对铝合金的缓蚀作用研究较少。无机缓蚀剂有硅酸钠、锡酸钠、稀土氧化物等[13,14]。Britop等[15,16]研究了羧酸类、胺类以及氨基酸类添加剂对Al腐蚀的抑制影响,认为这类添加剂可以看作是局部Al腐蚀抑制剂或Al在电解质溶液中的催化剂。Revel等探究了磷酸盐和铬酸盐对Al腐蚀速率的影响。结果表明磷酸盐对Al腐蚀几乎没有抑制作用;在CrO42-浓度较高的情况下,可以对Al腐蚀起到一定的抑制作用,但CrO42-浓度低时,抑制作用不明显[17]。
研究显示,在碱性溶液中添加ZnO,能在Al的表面上形成一层多孔疏松的锌盐层[8,18],但降低铝阳极自腐蚀的效果有限。为了提高锌盐层的致密性及与Al基体的附着力,本文设计在无机缓蚀剂ZnO的基础上加入有机缓蚀剂L-半胱氨酸。L-半胱氨酸有机缓蚀剂含有氨基 (—NH2) 和羧基 (—COOH) 极性基团,极性基团能吸附在金属表面上,非极性基团 (烃链) 形成疏水层,降低铝阳极的自腐蚀[19]。
制备铝阳极常用高纯铝 (≥99.99%,质量分数) 作为原料,因为纯度低的Al中含有较高含量的杂质元素 (Fe,Si),这些杂质元素在Al中一般以第二相存在,作为阴极相与Al基体构成微电池引起铝阳极析氢自腐蚀[9,12]。由于高纯铝价格昂贵,本文以降低Al自腐蚀为目的,选择常用的防锈铝合金3102作为铝空气电池的阳极材料。作为3000系铝合金的代表,3102铝合金应用广泛,它含有多种合金元素,这些合金元素能提高铝合金表面的析氢过电位[20]。本文主要研究以防锈3102铝合金作为铝空气电池阳极材料,在添加有机/无机复合缓蚀剂L-半胱氨酸/ZnO的4 mol/L NaOH溶液中的腐蚀性能及相应铝空气电池的放电性能,探讨3102铝合金作为铝空气电池阳极材料的可能性。
1 实验方法
1.1 材料准备
选用防锈铝合金3102 (河南盛世达防腐有限公司) 作为铝空气电池阳极材料,3102铝合金成分 (质量分数,%) 为:Mn 1.05,Zn 0.10,Fe 0.70,Si 0.40,Cu 0.10,Ti 0.10,Al余量。实验所用的4种溶液为:4 mol/L NaOH,4 mol/L NaOH+0.03 mol/L L-半胱氨酸,4 mol/L NaOH+0.2 mol/L ZnO和4 mol/L NaOH+0.03 mol/L L-半胱氨酸+0.2 mol/L ZnO。从3102铝合金锭上截取腐蚀及电化学测试试样,试样尺寸为Φ11.29 mm×5 mm,经金相砂纸依次打磨 (600#,800#,1000#,1500#,2000#),用蒸馏水及无水乙醇清洗,吹干。
1.2 电化学性能测试
在CHI660E电化学工作站上采用传统的三电极体系进行电化学性能测试,工作电极为3102铝合金试样,有效面积为1 cm2;Hg/HgO电极及石墨电极分别作为参比电极和辅助电极。电解质溶液为以上所述4种溶液。试样在溶液中浸泡1000 s后测试电化学阻抗谱 (EIS),测量信号为幅值5 mV的正弦波,频率为105~10-1 Hz。极化曲线测试在EIS测试后进行,扫描速率为1 mV/s。
1.3 自腐蚀速率测试
自腐蚀速率测试试样尺寸为Φ11.29 mm×5 mm,试样经金相砂纸依次打磨,用蒸馏水及无水乙醇清洗,干燥称重,在溶液中浸泡30 min,腐蚀产物用80 ℃的2% (质量分数) CrO3+5%H3PO4清洗5 min,然后用蒸馏水、无水乙醇清洗,干燥称重。腐蚀速率ν由下式计算:
式中,△m为自腐蚀浸泡失重 (mg),S为浸泡面积 (cm2),t为浸泡时间 (min)。根据下式计算缓蚀剂缓蚀率η:
式中,ν'corr和νcorr分别为添加缓蚀剂和不添加缓蚀剂的腐蚀速率。
1.4 电池性能测试
铝空气电池由铝阳极、空气阴极及电解液组成。阳极为3102铝合金;空气阴极由防水层、催化层、镍网导电骨架组成,MnO2为催化剂;电解液为上述4种溶液。在LAND-CT2001A电池测试系统上采用恒流放电测试铝空气电池放电性能,放电电流密度为20 mA·cm-2,放电时间为300 min。阳极试样放电前后清洗干燥称重,放电后阳极表面形貌及成分用扫描电镜 (SEM,JSM-5610LV) 及其配备的能谱仪 (EDX) 观测分析。另外对在NaOH/L-半胱氨酸/ZnO溶液中放电后未去除腐蚀产物的试样用X射线衍射仪 (XRD,D8 ADVANCE) 分析确定腐蚀产物。
阳极利用率η用下式计算:
式中,W为理论质量损失,W0为实际质量损失。
W用下式计算:
式中,Q为实际电容量,Q=5 h×0.02 A=0.1 A·h;Q0为理论电容量,Q0=2980 A·h·kg-1。
以上测试均平行进行3次,所得数值为3次测试的平均值。
2 结果与讨论
2.1 极化曲线
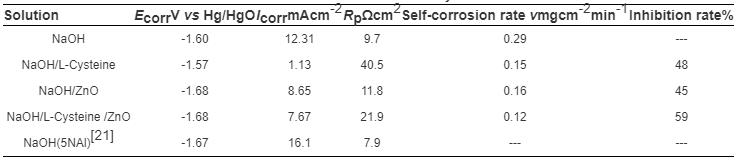
3102铝合金试样在NaOH,NaOH/L-半胱氨酸,NaOH/ZnO,NaOH/L-半胱氨酸/ZnO 4种溶液中的极化曲线如图1所示。根据极化曲线得出的铝合金的腐蚀参数如表1所示。在图1中,只添加L-半胱氨酸时,合金的腐蚀电位 (Ecorr) 正移,交换电流密度 (Icorr) 减小。在NaOH/ZnO,NaOH/L-半胱氨酸/ZnO溶液中,合金的Ecorr负移,Icorr减小。说明缓蚀剂的加入,减小了合金的腐蚀速率。另外,在含ZnO的溶液中,合金极化曲线的阳极分支上出现了一个电流峰。这是由于ZnO溶解,在铝合金表面生成了金属Zn层,如反应式 (5) 和 (6)。沉积的Zn在碱性介质中又溶解生成ZnO或锌盐。这些反应产物的沉积是一个阴极过程,导致阴极电流的降低[8],以上表明ZnO是一种成相型缓蚀剂。
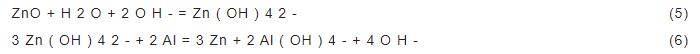
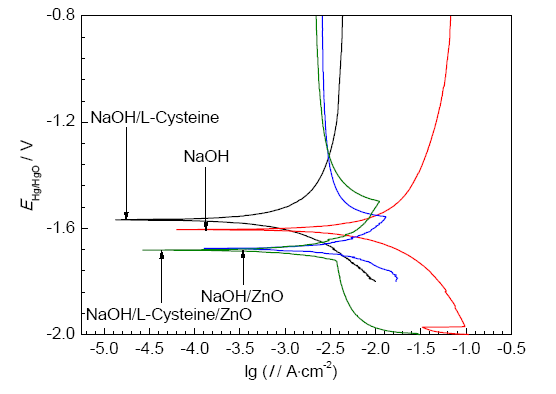
图1 3102铝合金在4种不同溶液中的极化曲线
表1 3102铝合金在4种不同溶液中的腐蚀参数
L-半胱氨酸 (C3H7NO2S) 含有氨基 (—NH2) 和羧基 (—COOH) 极性基团,这些极性基团和Zn或锌盐相互作用,一起吸附沉积在Al表面上 (反应 (7) 和 (8)),增大了沉积的Zn层与Al表面的附着力,非极性基团 (烃链) 形成疏水层,阻止了Al和H2O的接触,降低了Al及Zn的溶解。因此,合金在NaOH/L-半胱氨酸/ZnO溶液中具有较小的Icorr。
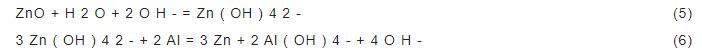
表1为根据极化曲线得出的3102铝合金在4种溶液中的腐蚀参数。Cho等[21]研究了5NAl在4 mol/L NaOH溶液中的电化学性能。从表1看出,3102铝合金在相同溶液中的Icorr比5NAl的小 (实验条件大致相同)。另外,3102铝合金在NaOH/L-半胱氨酸/ZnO溶液中具有较小的自腐蚀速率及较高的缓蚀率,这与极化曲线的测试结果一致。以上结果表明,本文选用3102防锈铝合金在碱性溶液中的耐蚀性能较5NAl好;在碱性介质中添加L-半胱氨酸/ZnO复合缓蚀剂后,合金耐蚀性能进一步提高。
2.2 电池放电性能
测试铝空气电池在20 mA·cm-2电流密度下的放电曲线如图2所示。电池在4种溶液中的电势-时间曲线相似,开始放电时电势的降低是由于电池内阻引起的,然后趋于平稳。合金在NaOH/ZnO溶液中,电势曲线有较大的波动,这是由于沉积的锌盐层附着与剥落引起的;而在NaOH/L-半胱氨酸/ZnO溶液中,电势曲线很平坦,这是由于有机/无机缓蚀剂L-半胱氨酸/ZnO共同作用的结果。表2为上述电池的放电性能,可以看出3102铝合金在NaOH/L-半胱氨酸/ZnO溶液中具有较高的阳极利用率及电池电势。
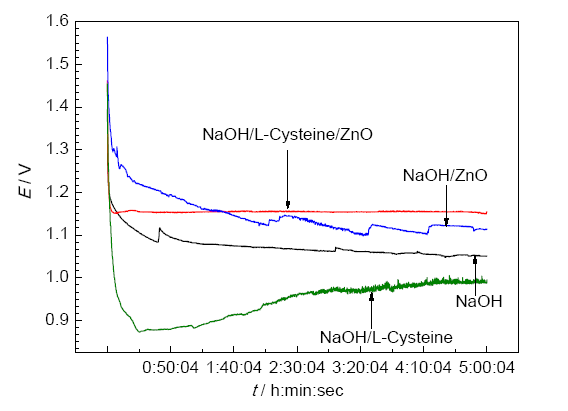
图2 铝空气电池在4种不同溶液中20 mAcm-2下的放电曲线
表2 铝空气电池在不同电解质中的放电性能

2.3 放电后表面形貌
图3所示为3102铝合金在不同溶液中放电后的表面形貌。合金在NaOH及NaOH/L-半胱氨酸溶液中的表面形貌相似,由一些小的圆形蚀坑组成,蚀坑中分布着一些白色的小颗粒 (图3a和b)。图4为3102铝合金在NaOH溶液中放电后表面白色颗粒的EDS分析,白色颗粒主要含有Al,Si,Fe和Mn。一般来说,含有Fe的第二相与基体Al构成微腐蚀电池,导致铝合金的局部腐蚀,增大铝合金的自腐蚀速率,降低铝阳极的利用率[22]。但加入Mn后,铝合金中Fe的存在形式从Fe3Al相转变成 (Fe,Mn)3Al相,而 (Fe,Mn)3Al与基体Al的电位相差很小,减小了由于Fe的存在而引起的铝合金的自腐蚀[23]。
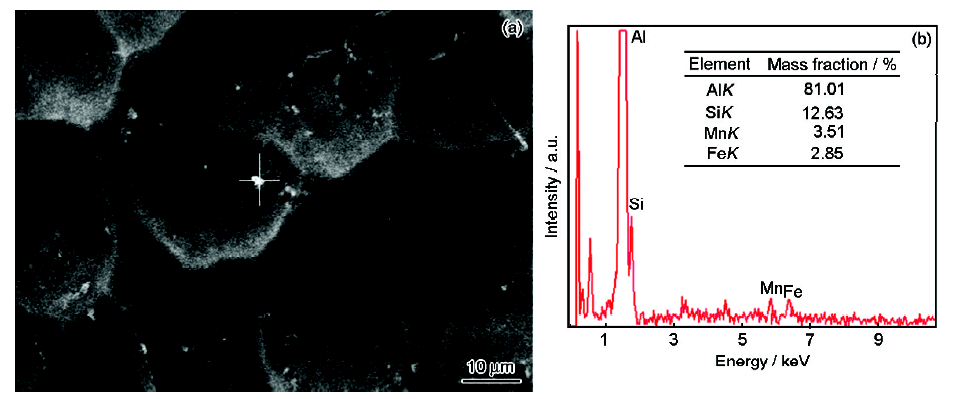
图4 3102铝合金在4 mol/L NaOH溶液中放电后的形貌及EDS结果

图3 3102铝合金在4种不同溶液中放电后的表面形貌
3102铝合金在NaOH/ZnO及NaOH/L-半胱氨酸/ZnO溶液中的放电形貌也相似,表面覆盖有白色物质 (图3c和d)。但只添加ZnO时,覆盖物团聚疏松 (图3c);而L-半胱氨酸的添加使得生成物均匀覆盖在合金表面 (图3d),增加了生成物层与铝基底的附着力,增强了ZnO的缓蚀效果。图5为3102铝合金在NaOH/L-半胱氨酸及NaOH/L-半胱氨酸/ZnO溶液中放电后表面腐蚀产物的XRD谱。在NaOH/L-半胱氨酸溶液中,腐蚀产物主要为Al2O3·3H2O (图5a)。在NaOH/L-半胱氨酸/ZnO溶液中,腐蚀产物主要为Zn,Al2O3·3H2O,Zn(OH)2和ZnO (图5b),表明ZnO在溶液中发生了反应 (5) 和 (6),生成了Zn和 Zn(OH)2,ZnO为成相型缓蚀剂。另外,腐蚀产物中并没有L-半胱氨酸的络合物,说明L-半胱氨酸形成的络合物没有参与Al表面钝化膜的生成,只是在介质中吸附于铝合金表面,属于吸附型缓蚀剂。3102铝合金在NaOH/ZnO、NaOH/L-半胱氨酸/ZnO溶液中放电后表面腐蚀示意图见图6。
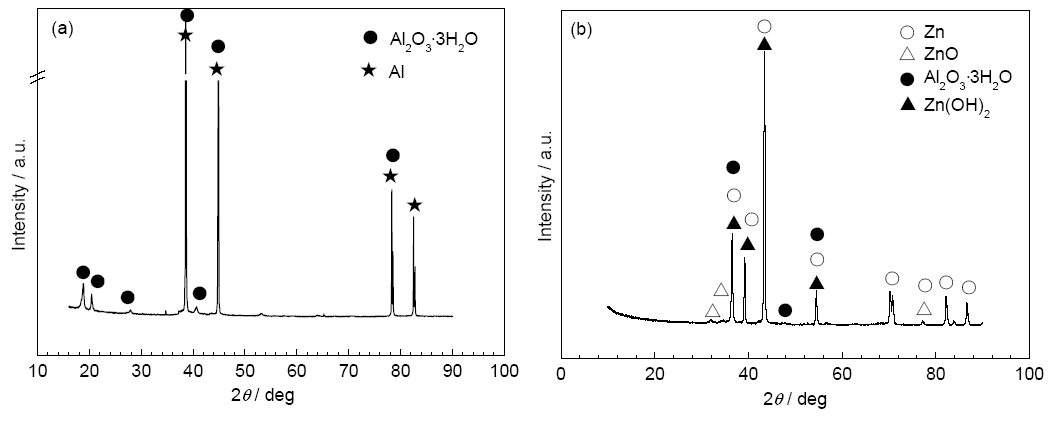
图5 3102铝合金在4 mol/L NaOH+0.03 mol/L L-半胱氨酸和4 mol/L NaOH+0.03 mol/L L-半胱氨酸+0.2 mol/L ZnO溶液中放电后表面腐蚀产物的XRD谱
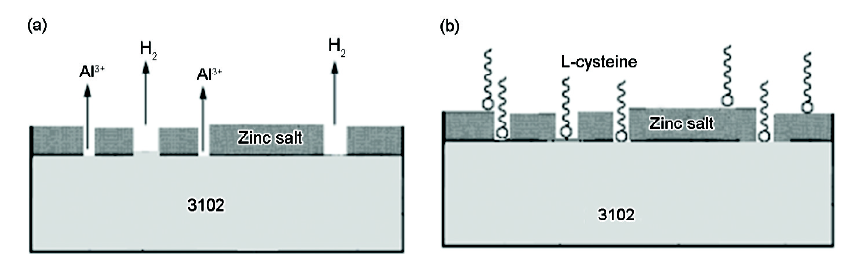
图6 3102铝合金在4 mol/L NaOH+0.2 mol/L ZnO和4 mol/L NaOH+0.03 mol/L L-半胱氨酸+0.2 mol/L ZnO溶液中放电后表面腐蚀示意图
2.4 电化学阻抗谱 (EIS)
3102铝合金在不同溶液中的EIS结果如图7所示。合金在NaOH及NaOH/L-半胱氨酸溶液中的EIS由高频和低频两个容抗弧组成 (Fig.7a)。高频容抗弧是由于合金表面电化学反应 (Al-Al+) 的电荷转移引起的,如反应式 (9) 和 (10) 所示;而低频容抗弧是由于合金表面钝化膜或腐蚀产物Al(OH)3和Al(OH)4-的附着产生的[24]。等效电路如图8a所示[25,26],其中,Rs是溶液电阻,Rt为电荷转移电阻 (Al-Al+),CPE1为双电层电容的常相位角元件1,R2为电荷转移电阻 (Al+-Al3+),CPE2为双电层电容的常相角位元件2。
Al + 3OH- → Al (OH)3 ↓ + 3e-(9)
Al (OH)3 + OH- → Al(OH)4 -(10)
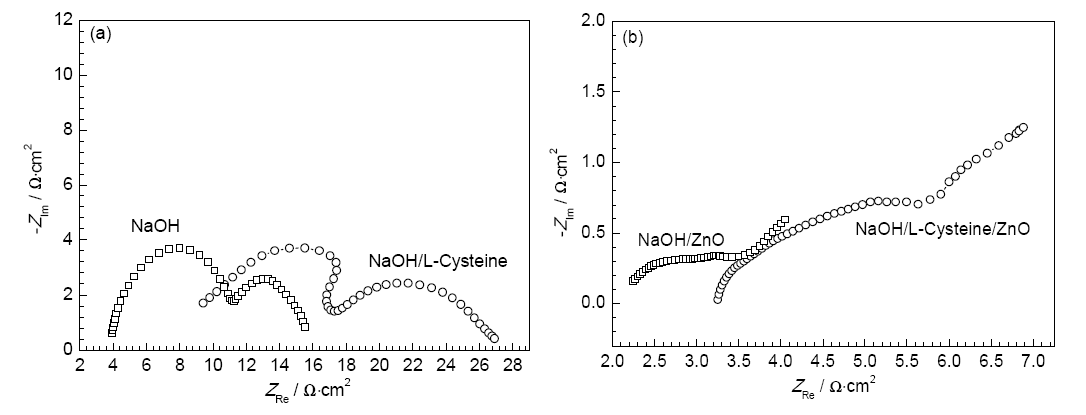
图7 3102铝合金在4种不同溶液中的电化学阻抗
合金在NaOH/ZnO及/NaOH/L-半胱氨酸/ZnO溶液中的EIS由高频容抗弧和低频约45°的斜线组成 (图7b)。低频45°斜线是典型的Warburg阻抗特征,是由半无限扩散引起的[27]。这表明,3102铝合金在NaOH/ZnO及NaOH/L-半胱氨酸/ZnO溶液中电化学反应由电荷在锌盐或腐蚀产物的扩散所控制。等效电路如图8b所示,其中,ZW表示锌盐或腐蚀产物扩散的Warburg阻抗。
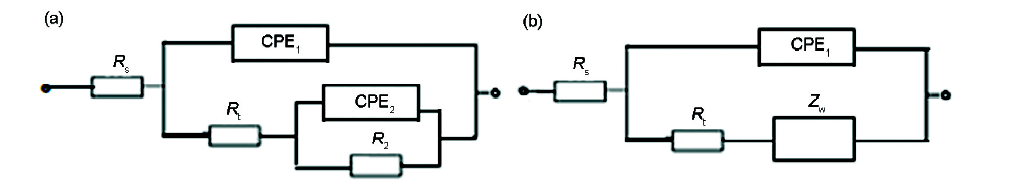
图8 3102铝合金在4种不同溶液中的等效电路
3 结论
(1) L-半胱氨酸/ZnO复合缓蚀剂明显降低了3102铝合金的自腐蚀速率,且该合金作为阳极的铝空气电池在NaOH/L-半胱氨酸/ZnO溶液中具有较高的电势及阳极利用率。
(2) L-半胱氨酸属于吸附型缓蚀剂,而ZnO属于成相型缓蚀剂。
(3) 在NaOH及NaOH/L-半胱氨酸溶液中,3102铝合金溶解主要由电荷转移控制;而在NaOH/ZnO及NaOH/L-半胱氨酸/ZnO溶液中,3102铝合金溶解主要由锌盐或腐蚀产物的扩散所控制。
The authors have declared that no competing interests exist.
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





