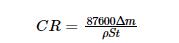摘要
采用电化学方法(电化学阻抗和动电位极化)并配合浸泡失重法以及一系列表征,研究了常温下碳钢基体与CO2-Cl-的界面反应,以及加入HCO3-介质后CO2-Cl--HCO3-体系中HCO3-介质对碳钢表面的成膜。结果表明,CO2介质的加入使碳钢基体的溶解速率显著提高但是对Cl-浓度的影响较小;添加高浓度的Cl-反而抑制CO2的溶解而使基体的腐蚀速率略微降低;在CO2+Cl-+HCO3-体系中加入微量的HCO3-后碳钢表面成膜不明显,疏松的腐蚀产物不能抑制碳钢基体的进一步溶解;浓度过高的HCO3-使FeCO3的过饱和度提高从而加速细小晶体的析出,抑制腐蚀的进行。
关键词: 金属材料 ; 多介质协同作用 ; 电化学技术 ; 腐蚀机理
本文引用格式
张少华, 李彦睿, 卫英慧, 刘宝胜, 侯利锋, 杜华云, 刘笑达. 多介质在碳钢腐蚀过程中的协同作用. 材料研究学报[J], 2021, 35(10): 721-731 DOI:10.11901/1005.3093.2021.004
ZHANG Shaohua, LI Yanrui, WEI Yinghui, LIU Baosheng, HOU Lifeng, DU Huayun, LIU Xiaoda. Synergistic Effect of Multi-media on Carbon Steel Corrosion. Earth Science[J], 2021, 35(10): 721-731 DOI:10.11901/1005.3093.2021.004
输送石油和天然气的管线,是石油工业的“命脉”[1, 2]。集输管线的腐蚀使其发生泄露式开裂而引起爆炸,可能造成重大安全事故和环境污染[3]。在油气生产和运输的管线中,存在着油气田中的CO2气体和地层水[4, 5]。CO2溶解在地层水中生成的H2CO3,对碳钢管线的腐蚀性极强 [6, 7]。在管线流的不同区域,地层水中分布着不同浓度的Cl-离子[8]。文献[9]研究了CO2与Cl-对油气管线腐蚀的交互作用并解释其机理,但是在工程条件下管线的腐蚀体系更为复杂。例如,NaHCO3作为一种pH值稳定剂常注入管线流中以限制其均匀腐蚀速率。HCO3-即能促进氧化膜的形成以增强碳钢表面的钝化[10, 11],还能发生两步氧化反应加速管线内部减薄。因此,HCO3-的临界浓度是控制腐蚀的关键[12]。
对于单一CO2、Cl-以及HCO3-介质的腐蚀机理,已进行了较多的研究。Linter、Burstein和Remita等[13, 14]研究了H2CO3的电化学活性、构建数学模型预测CO2环境中的阴极反应,但是并未发现H2CO3在钢表面的直接还原;关于CO2相关物质能否直接作用于碳钢阳极的溶解,学术界有不同的看法。Almedia等[15]认为,CO2没有直接作用在碳钢的自由表面,感抗弧的出现源于Fe-H2O相关物质的释放;而Kahyarian等[16]根据阳极极化曲线的Tafel斜率从28 mV/dec降至22 mV/dec认为,CO2相关物质能直接作用于碳钢阳极影响其溶解,关键是实验采用暂态技术还是稳态Tafel技术。关于Cl-是否催化阳极溶解,前者提出Cl-能形成中间配合物使铁基体溶解加速[17, 18];但是Barcia认为,在Fe*(Ⅰ)ads和Fe(Ⅱ)ads结构中Cl-与OH-相互竞争,当体系的pH值不小于3时Cl-对铁基体阳极溶解的影响较小[19]。关于HCO3-的研究,主要集中在阴极析氢反应和阳极钝化成膜反应:Mao等[20]发现,在HCO3-的浓度为0.5 mol/L和1.0 mol/L极化曲线出现典型的阳极电流峰时,碳钢表面发生钝化;而Zhang和Wright等[21, 22]则认为,过高浓度的HCO3-将使阴极反应加速。这些研究,加深了对碳钢在单一CO2、Cl-及HCO3-介质体系中腐蚀机理的解释。本文采用电化学技术(电化学阻抗与动电位极化)并配合浸泡失重法和一系列表征,研究油气管线内多介质(CO2、Cl-、HCO3-)之间的协同作用对管线腐蚀的影响。
1 实验方法
1.1 样品制备
实验用优质20碳素结构钢管线的化学成分,如表1所示。用于浸泡实验的试样其尺寸为50 mm×10 mm×4 mm,用于电化学实验的试样其尺寸为15 mm×15 mm×4 mm。实验前用丙酮将试样除油,然后用SiC砂纸将其逐级打磨至2000#,用去离子水、无水乙醇依次清洗后用冷风吹干,放在干燥皿中备用。将部分试样抛光后用脱脂棉蘸取5%的硝酸酒精擦拭试样表面1 min,用于观察显微组织(图1所示),可见主要由铁素体(区域A)和珠光体(区域B)组成。实验用腐蚀介质可分为三个体系:(1)在N2脱氧条件下,只包含0.2/1.0 mol/L Cl-介质的溶液体系;(2) 0.2/1.0 mol/L Cl-+饱和CO2溶液体系;(3) 0.1 mol/L Cl-+0/0.05/0.1/0.5 mol/L HCO3-+饱和CO2溶液体系。
表1 实验用20碳钢的化学成分
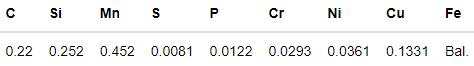

图1 20碳钢的显微组织和区域A/B的EDS结果
1.2 浸泡测试
在容积为1 L的高温高压反应釜中进行浸泡实验,其装置如图2所示。实验前,有精度为0.0001 g的分析天平将实验用试样称重,然后用游标卡尺测定尺寸以计算其表面积。每次实验使用6个试样,将其挂在反应釜的特定位置后向反应釜内加入相应体系的腐蚀介质(0.6 L),使试样在溶液中的高度相同。溶液相对试样的流速为60转/min。将反应釜密封,对应不同腐蚀体系通入相应的气体介质。腐蚀浸泡实验达到预设的周期后迅速取出试样,依次用去离子水和无水乙醇充分清洗后用冷风烘干,放入干燥皿中待测。其中的3个试样用于计算腐蚀速率,将其放入酸洗液(酸洗液的配制:500 mL ρ=1.19 g/mL盐酸+3.5 g六次甲基四胺,加蒸馏水配制成1000 mL溶液,GB/T 16545-1996,China,idt ISO 8407,1991)中用超声振动3 min以去除其表面腐蚀产物[19],然后用去离子水和无水乙醇依次清洗后用冷风吹干,用天平称量并记录数据。腐蚀速率为

图2 浸泡实验系统
其中Δm为样品腐蚀后的质量损失(g);ρ为材料的密度(g/cm3);S为试样暴露在溶液中的面积(cm2);t为浸泡腐蚀时间(h)。其余的试样用于表面形貌分析和成分检测。
1.3 电化学阻抗测试和动电位极化测试
电化学阻抗测试系统由Bio-logic SP-150电化学工作站、电化学反应釜、标准的三电极体系以及配套设备组成。工作电极为20碳钢试样,参比电极为饱和甘汞电极,辅助电极为铂电极。
试样暴露在腐蚀介质中的面积为1.0 cm2。在工作电极背面焊接导线,将工作面积外的部分用环氧树脂封装。实验前用SiC砂纸将试样表面打磨,用无水乙醇将电极表面清洗后干燥。为了减小溶液的电阻,将工作电极与参比电极之间用鲁金毛细管连接。每次开始测试电化学阻抗前,都需经过大约2 h的开路电位测试以使体系达到相对稳定状态。测试频率范围为100 kHz~10 mHz,线性正弦扰动为10 mV。测试结束后用ZSimDemo软件拟合阻抗曲线的数据以得到所需参数。每组电化学实验都至少进行5次,以确保实验的重复性。
动电位极化测试使用与电化学阻抗测试相同的装置。开路电位稳定后进行动电位极化测试,扫描速率为0.5 mV/s。测试结束后将数据拟合以得到腐蚀电位Ecorr和电流密度Icorr等参数。
1.4 表面形貌的表征
用扫描电子显微镜(SEM)观察腐蚀产物的表面和截面形貌,结合X射线衍射仪(XRD)和能谱分析仪(EDS)分析腐蚀产物的化学成分以确定腐蚀产物的组成。
2 结果和讨论
2.1 动电位极化曲线和电化学阻抗(CO2+Cl-体系)
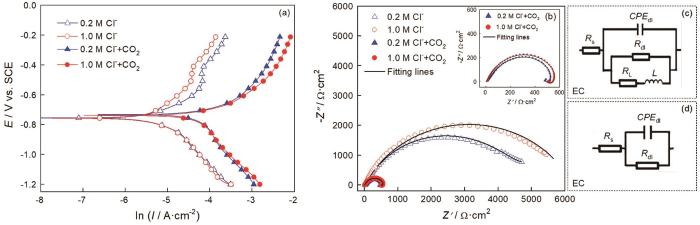
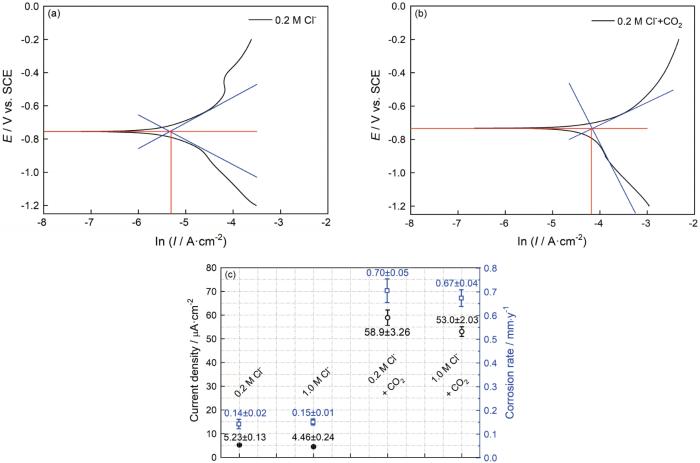
图3给出了25℃下碳钢在0.2/1.0 mol/L Cl-和0.2/1.0 mol/L Cl-+CO2(1 bar)溶液体系中的动电位极化曲线和电化学阻抗谱。拟合具有代表性的动电位极化曲线,如图4a、b所示。结合电流密度值(图4c)可以发现,在只有Cl-介质的溶液体系中,Cl-浓度的提高使阳极极化曲线的腐蚀电流轻微减小,而阴极极化曲线保持不变。其原因是,氯离子浓度过高使溶液的粘度提高,进而使溶液内的传质环节受到限制;加入CO2介质,使极化曲线整体向高电流密度方向显著迁移。对于阴极部分,生成的H2CO3通过“buffering”效应在金属-电解质界面逐步解离产生H+,使阴极析氢反应显著增强;而阳极部分,CO2介质的加入促进Fe-H2O相关物质的释放,进而使碳钢基体的溶解加速[15]。
图3 碳钢在25℃的0.2/1.0 mol/L Cl-和0.2/1.0 mol/L Cl-+CO2(1 bar)溶液体系中的动电位极化曲线、Nyquist图和相应的等效电路
图4 碳钢在Cl-和Cl-+CO2 (1 bar) 溶液体系中的动电位极化曲线拟合结果以及相应的腐蚀电流密度和腐蚀速率
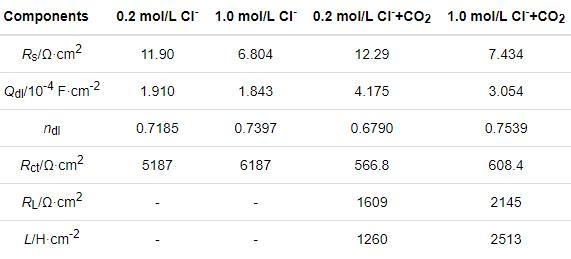
如图3b所示,电化学阻抗谱图具有与极化曲线相似的特征。分别用等效电路R(QR)和R(Q(R(RL)))拟合碳钢在0.2/1.0 mol/L Cl-和0.2/1.0 mol/L Cl-+CO2(1 bar)溶液体系中的阻抗数据,如图3c、d所示。等效电路中的元件由溶液电阻Rs、金属基体/电解质之间的双层容抗CPEdl、相位角常数ndl、电荷转移电阻Rct以及感应电阻RL和感抗L。所得的参数值列于表2。结合拟合结果发现,在有不同浓度Cl-的饱和CO2溶液体系中,碳钢的阻抗谱图有两个半圆,一个是与双电容相关的高频容抗弧,另一个是与Fe-H2O物质释放相关的低频感抗弧。这表明,在饱和CO2溶液体系中,Cl-浓度的提高并没有使碳钢的界面反应产生机理性转变。Cl-浓度的提高使阻抗弧半径稍有增大,因为过量的Cl-使溶解的CO2减少。但是,在只有Cl-介质的溶液体系中,碳钢的阻抗谱图只有容抗弧。同时,与有CO2-Cl-介质的溶液体系比较,碳钢在只有Cl-介质的溶液体系中的阻抗半径显著增加。这表明,CO2介质的加入使碳钢的腐蚀机制发生了变化。
表2 碳钢在0.2/1.0 mol/L Cl-和0.2/1.0 mol/L Cl-+CO2(1 bar)溶液体系中电化学阻抗谱的拟合参数
2.2 浸泡后的表面形貌(CO2+Cl-体系)
图5给出了在25℃下碳钢在0.2/1.0 mol/L Cl-和0.2/1.0 mol/L Cl-+CO2(1 bar)溶液体系中浸泡24 h后的表面形貌。腐蚀速率与腐蚀电流密度的变化趋势一致,如图4c所示。在只有Cl-介质的溶液体系中碳钢表面保持平整,只观察到样品制备过程中的划痕;CO2介质加入溶液体系后,碳钢表面出现均匀腐蚀的形貌,生成了较薄的腐蚀层(EDS与XRD结果指出其主要成分为Fe3C,如图5(e)/5(f)/5(g)所示)。考虑到碳钢的微观组织由铁素体-珠光体组成,Fe3C比铁素体的腐蚀电位更正。因此,在铁素体与Fe3C之间会形成一个电偶效应,铁基体的选择性溶解导致大量的Fe3C残余[23, 24]。较高的阴极位点进一步加速了碳钢的腐蚀,使其腐蚀速率较高。
图5 碳钢在25℃的0.2/1.0 mol/L Cl-和0.2/1.0 mol/L Cl-+CO2(1 bar)溶液体系中浸泡24 h后的表面形貌以及EDS/XRD结果
2.3 动电位极化曲线和电化学阻抗(CO2+Cl-+HCO3-体系)
针对HCO3-介质的加入,探讨CO2-Cl--HCO3-体系中三种介质的协同作用。于HCO3-介质的加入使碳钢表面膜化效应比较明显,且温度的提高有利于腐蚀产物的析出。因此,在60℃进行实验以突出HCO3-介质对碳钢表面腐蚀产物膜层的作用。
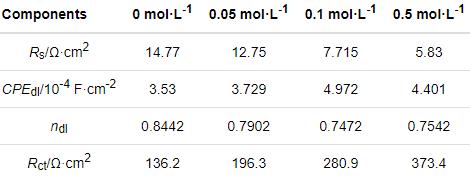
图6a给出了在60℃碳钢在CO2(1 bar)+0.1 mol/L Cl-+0/0.05/0.1/0.5 mol/L HCO3-溶液体系中的动电位极化曲线。首先,碳钢在CO2(1 bar)+0.1 mol/L Cl-溶液体系中表现出活性溶解行为。添加0.05 mol/L HCO3-介质后碳钢的阳极极化曲线基本与前者重合,表明添加此浓度的HCO3-介质并不能使碳钢的腐蚀过程发生明显的转变。而HCO3-浓度达到0.1/0.5 mol/L时,极化曲线发生显著的变化。即随着腐蚀电位的提高碳钢在初始阶段表现为活性溶解行为,然后发生“伪钝化”。其原因是,钝化电流密度还处于较高的电流密度区间,表明致密氧化膜层的形成,对碳钢基体有较强的保护。其间,可观察到一个明显的活化-伪钝化转变区间(电流密度随着电位的增加而急剧减小)。HCO3-的浓度达到0.5 mol/L时在-0.2 V vs. SCE以上的动电位区间几乎完全呈现出“伪钝化”现象。拟合极化曲线得到相应的参数值,如表3所示,即腐蚀电位(Ecorr)、“伪钝化”电位(Epass)、腐蚀电流密度(Icorr)和阴/阳极极化曲线斜率(βa/βc)。可以看出,随着HCO3-浓度的提高Ecorr值增加且Icorr值减小,腐蚀程度减弱。同时,Epass值的降低(0.1~0.5 mol/L)表明其钝化趋势显著增强。
图6 碳钢在60℃的CO2 (1 bar)+0.1 mol/L Cl-+0/0.05/0.1/0.5 mol/L HCO3-溶液体系中的动电位极化曲线和阻抗图
表3 碳钢在CO2 (1 bar)+0.1 mol/L Cl-+0/0.05/0.1/0.5 mol/L HCO3-溶液体系中所得动电位极化曲线的拟合参数值

为了阐明碳钢与CO2/HCO3-/Cl-介质之间的界面反应,测试了电化学阻抗,如图6b和6c所示。可以看出,Nyquist曲线由一个容抗组成,主要与碳钢表面的电荷转移电阻相关[25, 26]。用等效电路(R(QR))对EIS结果进行了拟合,结果如表4所示。对应0、0.05、0.1和0.5 mol/L HCO3-浓度下的chi-squared值分别为4.717×10-4、3.011×10-4、1.048×10-4和4.103×10-4,等效电路与实验数据的吻合程度较高。随着HCO3-浓度的提高容抗弧的半径略有增加,对应的电荷转移电阻Rct逐渐增大,可归因于CO2(1 bar)+0.1 mol/L Cl-溶液体系中碳钢表面的快速腐蚀;HCO3-释放到溶液中,碳钢表面吸附大量的HCO3-相关物质使界面反应受到抑制。同时,相位角和低频阻抗幅值|Z|(图6c)的逐渐增大也证明,在CO2(1 bar)+0.1 mol/L Cl-+HCO3-溶液体系中碳钢表面的耐蚀性提高。
表4 碳钢在CO2(1 bar)+0.1 mol/L Cl-+0/0.05/0.1/0.5 mol/L HCO3-溶液体系中的电化学阻抗谱拟合参数
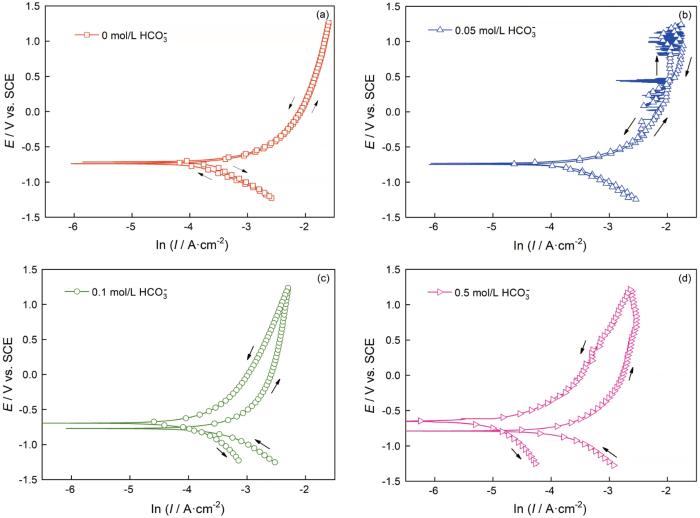
为了进一步验证HCO3-介质释放到溶液体系中碳钢表面的成膜效应,对CO2(1 bar)+0.1 mol/L Cl-+0/0.05/0.1/0.5 mol/L HCO3-溶液体系中的碳钢进行循环伏安测试,如图7所示。在CO2(1 bar)+0.1 mol/L Cl-溶液中碳钢的正向与反向极化曲线完全重合,表明碳钢表面基体维持裸露状态;0.05 mol/L HCO3-的加入使极化曲线的阳极部分出现较大的暂态电流,反映了碳钢的表面状态发生了不均匀的变化; 0.1/0.5 mol/L HCO3-介质的加入,使其反向极化曲线向电流密度减小的方向移动且腐蚀电位提高(尤其加入0.5 mol/L HCO3-介质),表明在碳钢表面形成了均匀致密的膜层。同时,分析碳钢在CO2 (1 bar)+0.1 mol/L Cl-+0/0.05/0.1/0.5 mol/L HCO3-溶液体系中一次极化后的表面SEM形貌,如图8所示。对于CO2(1 bar)+0.1 mol/LCl-溶液,碳钢电极呈现Fe+Fe3C的腐蚀形貌,其原因是铁素体的选择性溶解。HCO3-介质的浓度为0.05 mol/L时在碳钢表面出现少量的腐蚀产物,随HCO3-浓度提高到0.1/0.5 mol/L腐蚀产物均匀致密,覆盖了整个碳钢表面。这个结果,与图7中的循环伏安曲线相符。结合图8b中的面扫描图和文献[12, 27, 28],腐蚀产物的成分为γ-Fe2O3。其原因是,在电极极化条件下FeCO3的稳定性较差,随着电位的提高腐蚀产物以γ-Fe2O3的形式存在。
图7 碳钢在60℃的CO2(1 bar)+0.1 mol/L Cl-+0、0.05、0.1和0.5 mol/L HCO3-溶液体系中的循环伏安曲线
图8 碳钢在60℃的CO2 (1 bar)+0.1 mol/L Cl-+0、0.05、0.1和0.5 mol/L HCO3-溶液体系中极化到1.25 V vs. SCE的SEM形貌
2.4 浸泡后表面和横截面的形貌(CO2+Cl-+ HCO3-体系)
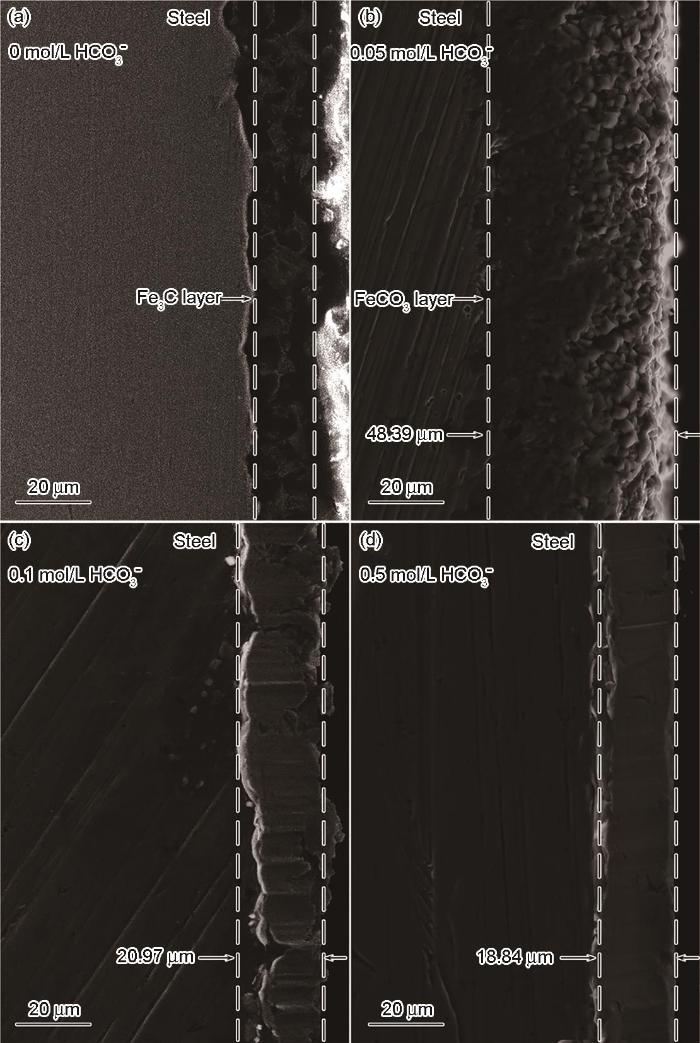
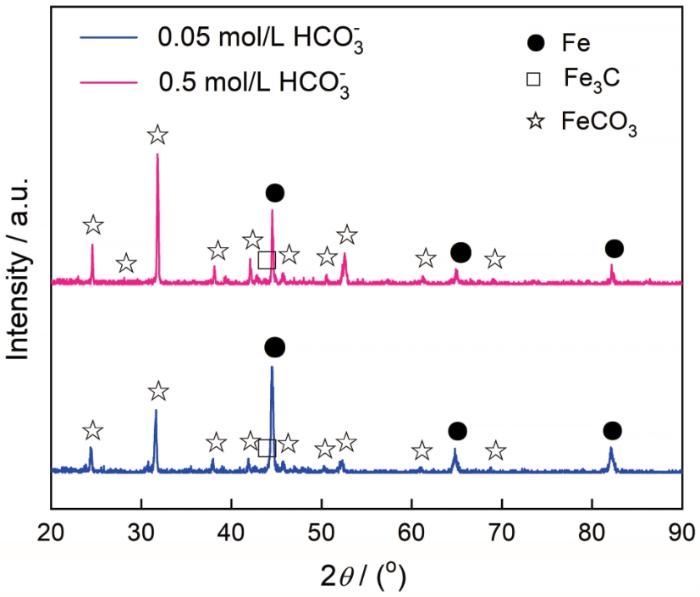
图9和图10分别给出了碳钢在60℃的CCO2(1 bar)+0.1 mol/L Cl-+0/0.05/0.1/0.5 mol/L HCO3-溶液体系中浸泡24 h后的表面和横截面SEM形貌。图11给出了碳钢在CO2+Cl-+0.05/0.5 mol/L HCO3-体系浸泡24 h后表面腐蚀产物的XRD谱。与电化学结果对应,在CO2 (1 bar)+0.1 mol/L Cl-溶液中(图9a和图10a)并没有观察到腐蚀产物,在碳钢的界面处生成了一层残余的Fe3C;HCO3-浓度达到0.05 mol/L时在碳钢表面生成了疏松且尺寸较大的FeCO3腐蚀产物,晶粒尺寸大约为8 μm(图9b)。截面形貌表明,疏松的腐蚀产物不能抑制腐蚀的进一步发生,因此腐蚀产物层的厚度达到了48.39 μm (图10b)。疏松的腐蚀产物可能使碳钢基体局部暴露在溶液中而加速碳钢的局部腐蚀,使碳钢局部失效的可能性提高。HCO3-浓度达到0.1/0.5 mol/L时FeCO3晶体尺寸变得更加细小,约3 μm (0.1 mol/L HCO3-)和1 μm(0.5 mol/L HCO3-),如图9(c/d)所示。腐蚀产物的横截面也呈现出非常致密的特征,厚度分别减小至20.97 μm(图10c)和18.84 μm(图10d)。且在XRD图谱中,随着HCO3-浓度的提高对应于Fe的峰强度降低,而对应于FeCO3的峰强度显著增强; HCO3-的浓度为0.5 mol/L时FeCO3的峰强度明显高于Fe基体,表明碳钢表面的FeCO3晶体的析出动力学加速,几乎覆盖了整个表面。致密的腐蚀产物在碳钢基体与腐蚀介质之间形成一个屏障,能有效地抑制腐蚀的进一步进行。另一方面,HCO3-的加入提高了溶液的pH值,显著降低了FeCO3晶体析出所需的Fe2+浓度,其相对过饱和度明显提高。同时,晶体的形核率随着相对过饱和度呈指数相关,而晶体长大速率随着相过相对饱和度呈线性相关。因此,随着HCO3-浓度的提高FeCO3晶体的形核主导了整个过程,在碳钢表面呈现出更加细小的FeCO3晶体形貌。为了进一步验证腐蚀产物的保护性,对覆盖有腐蚀产物的碳钢表面在CO2(1 bar)+0.1 mol/L Cl-溶液中进行EIS测试,如图12所示。同时,用电化学等效电路拟合EIS结果,加入膜层容抗CPEf、相位角常数nf和膜层电阻Rf。加入0.05 mol/L的HCO3-介质后其Nyquist图呈现出单一的容抗,在此条件下碳钢表面形成的腐蚀产物保护性较弱,以电荷转移电阻为主要控制环节;随着HCO3-浓度的提高(0.1~0.5 mol/L)出现两个容抗且半径变大,Rct和Rf值明显增加,表明腐蚀产物的耐腐蚀能力增强。这表明,碳钢表面的膜层已较为致密,界面反应控制环节主要由电荷转移电阻和膜层电阻组成。
图9 碳钢在60℃的CO2 (1 bar)+0.1 mol/L Cl-+0、0.05、0.1和0.5 mol/L HCO3-溶液体系中浸泡24 h后的表面SEM照片
图10 碳钢在60℃的CO2 (1 bar)+0.1 mol/L Cl-+0、0.05、0.1和0.5 mol/L HCO3-溶液体系中浸泡24 h后的横截面SEM照片
图11 碳钢在60℃的CO2 (1 bar)+0.1 mol/L Cl-+0.05/0.5 mol/L HCO3-溶液体系中浸泡24 h后腐蚀产物的XRD谱
图12 碳钢在60℃的CO2 (1 bar)+0.1 mol/L Cl-+0/0.05/0.1/0.5 mol/L HCO3-溶液体系中浸泡24 h后的Nyquist曲线
3 结论
(1) 加入CO2介质使碳钢基体的腐蚀溶解速率显著提高而对Cl-浓度的影响较小,添加高浓度的Cl-能抑制CO2的溶解而使基体的腐蚀速率略微降低。
(2) 在CO2+Cl-+HCO3-体系中加入微量的HCO3-后碳钢表面成膜不明显,疏松的腐蚀产物不能抑制碳钢基体的进一步溶解;而浓度过高的HCO3-使FeCO3的过饱和度提高、加速细小晶体的析出和抑制腐蚀。
参考文献
1 Zhao J H, Wang X Q, Kang J, et al. Crack propagation behavior during DWTT for X80 pipeline steel processed via ultra-fast cooling technique [J]. Chin. J. Mater. Res., 2017, 31(10): 728
1 赵金华, 王学强, 康 健等. 超快冷工艺下X80管线钢的DWTT裂纹扩展行为 [J]. 材料研究学报, 2017, 31(10): 728
2 Han X, Yu S, Li H, et al. Preparation and Properties of CuO Superhydrophobic Coating on X90 Pipeline Steel [J]. Chin. J. Mater. Res., 2017, 31(9): 672
2 韩祥祥, 于思荣, 李好等. X90管线钢表面CuO超疏水涂层的制备和性能 [J]. 材料研究学报, 2017, 31(9): 672
3 Sun J, Zhang G, Liu W, et al. The formation mechanism of corrosion scale and electrochemical characteristic of low alloy steel in carbon dioxide-saturated solution [J]. Corros. Sci., 2012, 57: 131
4 Zhang G A, Lu M X, Wu Y S. Morphology and microstructure of CO2 corrosion scales [J]. Chin. J. Mater. Res., 2005, 19(5): 537
4 张国安, 路民旭, 吴荫顺. CO2腐蚀产物膜的微观形貌和结构特征 [J]. 材料研究学报, 2005, 19(5): 537
5 Ne?i? S. Key issues related to modelling of internal corrosion of oil and gas pipelines-A review [J]. Corros. Sci., 2007, 49(12): 4308
6 Nesic S, Postlethwaite J, Olsen S. An electrochemical model for prediction of corrosion of mild steel in aqueous carbon dioxide solutions [J]. Corrosion, 1996, 52(4): 280
7 Zhu J Y, Tan C T, Bao F H, et al. CO2 corrosion behaviour of a novel Al-containing low Cr steel in a simulated oilfield formation water [J]. Chin. J. Mater. Res., 2020, 34(6): 443
7 朱金阳, 谭成通, 暴飞虎等. 一种新型含Al低Cr合金钢在模拟油田采出液环境下的CO2腐蚀行为 [J]. 材料研究学报, 2020, 34(6): 443
8 Han J, Ne?i? S, Yang Y. Spontaneous passivation observations during scale formation on mild steel in CO2 brines [J]. Electrochim. Acta, 2011, 56(15): 5396
9 Zhang S, Hou L, Du H, et al. A study on the interaction between chloride ions and CO2 towards carbonsteel corrosion [J]. Corros. Sci., 2020, 167: 108531
10 Xu L, Xiao H, Shang W, et al. Passivation of X65 (UNS K03014) carbon steel in NaHCO3 solution in a CO2 environment [J]. Corros. Sci., 2016, 109: 246
11 Liu Z, Gao X, Li J, et al. Corrosion behaviour of low-alloy martensite steel exposed to vapour-saturated CO2 and CO2-saturated brine conditions [J]. Electrochim. Acta, 2016, 213: 842
12 Barker R, Burkle D, Charpentier T, et al. A review of iron carbonate (FeCO3) formation in the oil and gas industry [J]. Corros. Sci., 2018, 142: 312
13 Linter B R, Burstein G T. Reactions of pipeline steels in carbon dioxide solutions [J]. Corros. Sci., 1999, 41(1): 117
14 Remita E, Tribollet B, Sutter E, et al. Hydrogen evolution in aqueous solutions containing dissolved CO2: quantitative contribution of the buffering effect [J]. Corros. Sci., 2008, 50(5): 1433
15 Almeida T D C, Bandeira M C E, Moreira R M. New insights on the role of CO2 in the mechanism of carbon steel corrosion [J]. Corros. Sci., 2017, 120: 239
16 Kahyarian A, Brown B, Nesic S. Electrochemistry of CO2 corrosion of mild steel: Effect of CO2 on iron dissolution reaction [J]. Corros. Sci., 2017, 129: 146
17 Ashley G W, Burstein G T. Initial stages of the anodic oxidation of iron in chloride solutions [J]. Corrosion, 1991, 47(12): 908
18 Darwish N A, Hilbert F, Lorenz W J, et al. The influence of chloride ions on the kinetics of iron dissolution [J]. Electrochim. Acta, 1973, 18(6): 421
19 Barcia O E, Mattos O R. The role of chloride and sulphate anions in the iron dissolution mechanism studied by impedance measurements [J]. Electrochim. Acta, 1990, 35(6): 1003
20 Mao X, Liu X, Revie R W. Pitting corrosion of pipeline steel in dilute bicarbonate solution with chloride ions [J]. Corrosion, 1994, 50(9): 651
21 Zhang G, Lu M, Chai C, et al. Effect of HCO3- concentration on CO2 corrosion in oil and gas fields [J]. Int. J. Min. Met. Mater., 2006, 13(1): 44
22 Wright R F, Brand E R, Ziomek-Moroz M, et al. Effect of HCO3- on electrochemical kinetics of carbon steel corrosion in CO2-saturated brines [J]. Electrochim. Acta, 2018, 290: 626
23 Onyejia L, Mohammed S, Kale G. Electrochemical response of micro-alloyed steel under potentiostatic polarization in CO2 saturated brine [J]. Corros. Sci., 2018, 138: 146
24 Popoola L T, Grema A S, Latinwo G K, et al. Corrosion problems during oil and gas production and its mitigation [J]. Int. J. Ind. Chem., 2013, 4(1): 35
25 Heuer J K, Stubbins J F. An XPS characteristic of FeCO3 films from CO2 corrosion [J]. Corros. Sci., 1999, 41(7): 1231
26 Zhang D L, Wei E Z, Jing H, et al. Construction of super-hydrophobic structure on surface of super ferritic stainless steel B44660 and its corrosion resistance [J]. Chin. J. Mater. Res., 2021, 35(1): 7
26 张大磊, 魏恩泽, 荆赫等. 超级铁素体不锈钢表面超疏水结构的制备及其耐腐蚀性能 [J]. 材料研究学报, 2021, 35(1): 7
27 Davies D H, Burstein G T. The effect of bicarbonate on the corrosion and passivation of iron [J]. Corrosion, 1980, 36(8): 416
28 Kermani M B, Morshed A. Carbon dioxide corrosion in oil and gas production-A compendium [J]. Corrosion, 2003, 59(8): 659
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606
- 邮箱:fsfhzy666@163.com
- 腐蚀与防护网官方QQ群:140808414