马力,闫永贵,李凯,张海兵
中国船舶重工集团公司第七二五研究所,海洋腐蚀与防护重点实验室,青岛,中国,266101
Email: mal@sunrui.net

作者简介:
马力,女,1977年3月生,博士,高级工程师,材料学专业,研究方向为电化学保护材料与技术,于中国船舶重工集团公司第七二五研究所青岛分部(海洋腐蚀与防护重点实验室)从事科研工作。
先后承担及参与了国防技术基础项目、总装预研先进材料、总装预研支撑技术、武器装备预研基金、环境试验与观测等多项军工科研项目及科技部十五攻关项目“埋地管道腐蚀速率快速检测技术”、自然科学基金“水环境中微生物膜下金属腐蚀机理研究”、青岛市科技创新项目“海水利用系统防腐防污及应用技术”等多项民口课题。首次开发了高温原油储罐保护用铝合金牺牲阳极材料、用于高强钢阴极保护专用材料低电位牺牲阳极、适用于深海高压低温低氧环境的深海牺牲阳极材料,提出了杂质元素对铝合金牺牲阳极电化学性能的影响机理,完善了牺牲阳极材料体系,丰富了牺牲阳极溶解理论,为海洋环境武器装备及民用海工设施的腐蚀防护提供了技术基础。在国内外学术会议和期刊发表论文20余篇,申请国家发明专利多项,指导多名研究生完成毕业论文。
联系方式
Tel: 0532-68725132
Email: mal@sunrui.net
摘 要:采用恒电流试验评价了Al-0.55%Zn-0.5%Bi阳极在低温海水中的电化学性能,利用金相显微镜观察了材料的微观组织,并通过回沉积试验研究了Bi对铝的活化作用。结果表明,随着温度的降低,该阳极宏观溶解性能未发生明显变化,电流效率也均在85%左右,但工作电位略有正移,常温时工作电位为-800~-820mV,在低温下则为-760~-790 mV。阳极的微观组织主要是均匀的α-Al固溶体加偏析相,大部分偏析相在晶界上呈链状分布,有的弥散分布在晶粒内。Bi对铝的活化作用机理符合“溶解-再沉积”机理。
关键词:低电位牺牲阳极;高强钢;低温;电化学性能
1 引言
牺牲阳极阴极保护是海洋工程和装备常用的腐蚀控制措施[1]。随着深海资源的开发和材料科学的进步,高强钢在海洋工程中的应用越来越广泛。传统牺牲阳极材料工作电位负于-1.00V,而高强钢材料具有氢脆敏感性,最佳保护电位范围不宜超过-800mV(vs.Ag/AgCl海水)[2,3]。因此采用传统的牺牲阳极会导致其氢脆敏感性的增加,给高强钢结构的安全服役带来潜在危险,需采用电位较正的阳极材料。
针对这一问题,最早提出了在被保护结构和牺牲阳极中间增加限压二极管[4],或者串联电阻的方法进行限压,但该方法成本较高,且会随着二极管的损坏而造成限压失效。铁阳极也曾作为低电位阳极保护铜而得到了较为广泛的应用[5],但由于铁阳极与高强钢之间的电位差太低而不适合应用于高强钢的腐蚀保护。为克服上述方法的缺陷,美法海军联合研制了低电位牺牲阳极材料AG2,但其溶解性能较差[6,7]。美海军标MIL-DTL-24779B(SH)专门针对低电位牺牲阳极的性能做了规定,美国海军实验室于2009年再次立项对该产品开展研究,目前未见相关报道。中船重工七二五所研制了常规环境中具有良好综合电化学性能的低电位牺牲阳极材料[8,9],但其在深海环境中的性能尚未开展研究。由于深海环境具有低温的特点,温度是影响材料腐蚀行为的重要参数。因此,本文针对前期研制的Al-Zn-Bi低电位牺牲阳极,研究了其在低温海水中的电化学性能,以期为该阳极在深海环境中的应用提供基础数据。
2 试验方法
2.1 试验材料
采用电阻炉熔化工业铝锭Al99.85,当温度达到780oC时,加入预先称量好的合金元素Zn和Bi,并用石墨棒搅拌均匀,拔渣浇铸成Φ20mm×600mm的棒状试样。阳极熔炼完毕采用原子发射光谱分析成份,实际成份和设计成份基本一致,其成分为Al-0.55%Zn-0.5Bi。
2.2 电化学测试
将浇铸好的阳极加工成Φ16mm×48mm的圆柱状试样,试样表面经无水乙醇除油,去离子水冲洗,烘干后用精度为10-4g的分析天平称重。试样预留工作面积14cm2,其余部分用绝缘胶带涂封。根据GB17848-1999对阳极电化学性能进行评价,试验介质为青岛近海海滨天然海水,阳极工作电流密度为1mA/cm2,阴阳极面积比为1:60,参比电极为饱和甘汞电极(为便于和文献中高强钢阴极保护标准的对比,如未加标注,文中电位值均为换算成相对于Ag/AgCl海水参比电极),每天测量并记录阳极工作电位,试验周期为240h。试验结束后,除去试样表面涂封物,并用浓硝酸浸泡试样除去腐蚀产物,用去离子水清洗干净后烘干称重,观察阳极溶解形貌,并计算阳极电容量。
2.3 微观组织观察
将阳极用水砂纸打磨,采用20V直流电压进行电解抛光,0.5%HF水溶液刻蚀,去离子水、无水乙醇清洗并吹干。采用Axiovert-200MAT型号的金相显微镜观察微观组织并拍摄照片。
2.4 回沉积试验
将纯度为99.99%的4mm×6mm×1mm的纯铝片和Φ16mm×48mm的Al-Zn-Bi阳极试样同时浸于2L海水中,以铂铌丝为辅助电极,将Al-Zn-Bi试样施加1mA/cm2电流进行阳极极化,使阳极不断溶解,监测纯铝片的电位变化,对试验后纯铝的表面进行能谱分析,检测Bi含量的变化情况,分析溶液中的Bi3+有无沉积到纯铝片表面。
3 结果与讨论
3.1 电化学性能
表1是Al-Zn-Bi阳极在不同温度海水中的电化学性能。表中结果显示,在不同温度的海水中,阳极的开路电位和工作电位随着海水温度的降低呈正移趋势,但正移幅度不大,均在-0.760V~-0.820V之间,符合低电位牺牲阳极所要求的工作电位范围。阳极电容量低温下较常温时略低,但相差不大,均具有较高的效率,在85%左右。表明该阳极可用于低温海水环境,但需注意其与被保护结构是否有足够的驱动电位以提供充分保护。
表1 Al-Zn-Bi阳极的低温电化学性能
| 性能温度oC | 4 | 8 | 12 | 25 | |
| 开路电位/V | -0.808 | -0.823 | -0.836 | -0.881 | |
| 工作电位 /V |
-0.760~-0.766 | -0.768~-0.777 | -0.771~-0.790 | -0.801~-0.814 | |
| 实际电容量 /A·h/Kg |
2505 | 2506 | 2508 | 2565 | |
| 电流效率/% | 84.8 | 84.8 | 84.9 | 86.8 | |
| 溶解形貌 | 溶解均匀,产物易脱落 | 溶解均匀,产物易脱落 | 溶解均匀,产物易脱落 | 溶解均匀,产物易脱落 |
#p#副标题#e#


图1. Al-Zn-Bi阳极的溶解形貌
图1是阳极在不同温度海水中的宏观和微观溶解形貌。观察溶解形貌可知,溶解性能在低温时较常温下并无明显差异,这也是电流效率比较接近的原因。但从微观溶解形貌观察可知,在温度低时,点蚀坑较小,有的溶解很深,以小孔形式深入扩展,在温度较高时点蚀坑较大,溶解较浅。也即在低温下阳极的溶解向纵深发展的趋势更明显,表明低温不利于阳极均匀溶解,原因和低温时氧的扩散速度及离子的迁移速度低有关。
3.2 阳极的金相组织
阳极的金相组织如图2所示。结果显示,阳极的微观组织主要是均匀的α-Al固溶体加上偏析相。这是因为Bi元素在铝中的溶解度很小(<0.1wt%),多余部分以偏析相的形式析出。大部分偏析相在晶界上呈链状分布,有的弥散分布在晶粒内。这种较为均匀的微观组织使得阳极材料具有良好的溶解性能和较高电流效率。

图2. Al-Zn-Bi阳极的金相组织
3.3 回沉积试验
图3是高纯铝片试样的开路电位-时间曲线。从图中结果可知,高纯铝试样的电位随时间延长有逐渐负移的趋势,最后基本达到稳定,在-0.940V左右。分析该现象的原因,一种可能是是高纯铝试样的表面有负电性的离子吸附(如Cl-),也即海水中的Cl-具有侵蚀性使得铝表面的钝化膜破裂;另一种可能是有活化元素Bi回沉积在其上,破坏了铝的氧化膜从而使其活化。#p#副标题#e#
为了研究活化点产生的原因,对高纯铝表面进行了能谱分析。图4所示为试验结束后高纯铝试样表面沉积物的能谱分析结果。图中结果显示,高纯铝试样
图3 高纯铝试样电位-时间曲线
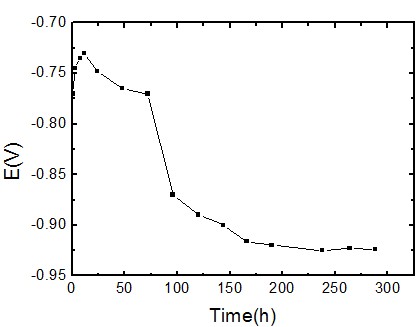
图4 高纯铝表面能谱分析

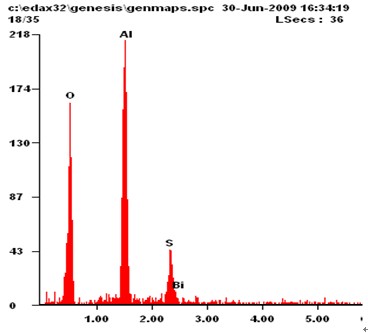

表面有Bi元素回沉积的现象。表明部分被氧化的铋离子被还原,生成Bi沉积在高纯铝试样表面,破坏了表面氧化膜,使基体铝活化。上述试验结果可以证明:在Al-Zn-Bi合金牺牲阳极中,活化元素Bi使铝基体活化以后,部分被氧化的Bi又重新被还原回沉积在阳极试样,促使合金的进一步活化,从而验证了Bi对Al的活化符合Reboul的“溶解-再沉积机理”[10]。
4 结论
(1)低温海水中,Al-Zn-Bi牺牲阳极工作电位较常温海水中偏正,常温海水中阳极的工作电位为-800~-820mV,而在低温下则为-760~-790 mV。溶解性能无明显差异,电流效率也均在85%左右。
(2)阳极的微观组织主要是均匀的α-Al固溶体加偏析相,大部分偏析相在晶界上呈链状分布,有的弥散分布在晶粒内。
(3)Al-Zn-Bi阳极溶解后,部分被氧化的Bi重新被还原回沉积在阳极试样,使得铝的氧化膜破裂,促使合金的进一步活化,符合“溶解-再沉积”机理。
References(参考文献)
[1] Gurrappa I. Aluminum alloys for cathodic protection [J]. Corrosion Prevention & Control, 1997, 44(3): 69-80.
[2] Billingham J., ShaRp J.V.. Review of the performance of high strength steels used offshore. Health&Safety Executive, 2003:111
[3] Batt C.L. and Robinson M.J.. Cathodic Protection Requirements for High Strength Steel[J]. British Corrosion Journal. 2002, 37 (1): 31~36
[4] GuriE.Nustad. Resistor Controlled Cathodic Protection for Stainless Steel in Chlorinated Seawater. Paper No.03082, Corrosion2003, NACE, Houston, TX, 2003
[5] Deng Y.S. Performance and Application of Iron Anode in Seawater[C].4th National Corrosion Conference.2003
(邓永生. 铁阳极在海水介质中的性能及应用[C].第四届全国腐蚀大会.2003年)
[6] Pautasso J.P., Guyader H.Le and Debout V..Low voltage cathodic protection for high strength steels:Part 1-Definition of a new aluminum galvanic anode material[J]: Paper No. 725, Corrosion98, NACE, Houston, TX, 1998
[7] Lemieux E, Keith E, Lucas E A. Hogan. Performance Evaluation of Low Voltage Anodes for Cathodic Protection[J]. Corrosion, 2002, 58(1): 16-27
[8] Yan Y.G., Ma L. and Qian J.H.. Low Driving Voltage Aluminum Alloy Anode. [P]. 200810249622
[9] Ma L., Li K.Yan Y.G.. Low voltage aluminum alloy anode for cathodic protection of high strength steel. Advanced Materials Research 2009 Vol79~82:1047~1050
[10] Reboul M.C., Gimenez PH. and Rameau J.J.. A Proposed Activation Mechanism for Al Anodes. Corrosion. 1984(40):366~371

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62313558-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414




