
所谓腐蚀
腐蚀是指材料与环境间发生的化学或电化学相互作用而导致材料功能受到损伤的现象。
腐蚀电池
在大多数情况下,当金属被放置在水溶液中或潮湿的大气环境中时,金属表面会形成一种微电池,有时也称腐蚀电池(其电极一般称为阴、阳极)。
在阳极上发生氧化反应,使阳极发生溶解,在阴极上则发生还原反应,一般只起传递电子的作用。
形成原因
腐蚀电池的形成原因主要是由于金属表面吸附了空气中的水分,形成了一层水膜,因而使空气中CO?、SO2和NO2等气体溶解在这层水膜中,形成电解质溶液,而浸泡在这层溶液中的金属又总是不纯的,例如工业上用的钢铁,其实际上是合金材料,即除铁之外,还含有石墨、渗碳体(Fe3C)以及一些其它的金属和杂质,它们大多数没有铁元素活泼。这样形成的腐蚀电池的阳极为铁,而阴极为杂质,又由于铁与杂质紧密接触,使得腐蚀不断进行。
发生腐蚀作用期间,来自金属表面不同区域的电子在具有导电功能的氛围中流动到其他区域,这是较为简单的化学腐蚀。不同的电化学腐蚀对于材料所造成的影响也不尽相同。
可怕的腐蚀!!!
事实上,因为腐蚀而造成的经济损失远远大于许多人的认知。据CC Technologies Laboratories Inc.在2001年做出的一项研究报道称:仅在美国,腐蚀成本每年就高达2760亿美元,其中,用于管理腐蚀的费用为1210亿美元,而剩余的1550亿美元是则对经济造成的净损失。公共事业,特别是水管和下水道系统受到的经济损失最大,其次为机动车辆和运输行业。
由于金属腐蚀是一个持续的电化学过程,因此了解电化学反应的本质特性至关重要,这将有助于技术人员合理的抑制腐蚀并减少其对结构的影响。
今天我们就将先为大家介绍涉及腐蚀的三类化学反应
电化学反应
丹尼尔电池
阳极反应
什么是腐蚀电化学?
在水性环境和大气环境中发生的腐蚀本质上是一种电化学反应,是由于电子在金属表面和液体电解质溶液之间互相转移而造成的,通常会导致基板材料性能的劣化。
腐蚀发生是因为金属与氧气、水和大气中的其他物质发生电化学反应的倾向很大。在这种情况下,术语“阳极”用于表示真正腐蚀的金属表面部分,而“阴极”则用于表示消耗由腐蚀反应产生的电子的金属表面。
研究电化学反应腐蚀方面的早期先驱学者Ulick R. Evans说,腐蚀可以被理解为由于发生电化学反应而造成的破坏现象。因此,腐蚀电化学只是一种电化学反应,通过它人们可以更好的了解腐蚀的机理。
电化学反应
电化学反应被概述为涉及到电子转移的反应。此外,这也是一个涉及氧化和还原的反应。
腐蚀一般由至少一个化学反应以及一个并不完全明显的还原反应组成,不过这两个反应经常会在一片金属(例如锌)中结合在一起发生,如下图所示。
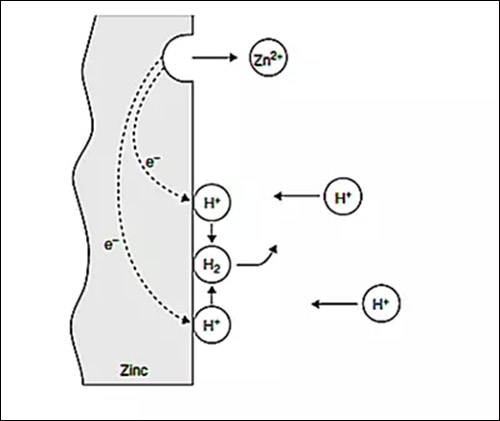
图1:在无空气盐酸溶液中锌腐蚀过程中发生的电化学反应
在图1中,浸入到酸溶液中锌片(Zn)正在经历腐蚀。在其表面上的某一点,Zn失去电子转变为Zn离子,这些电子穿过固体导电金属到金属表面上的其他区域,这些区域上的氢(H)离子通过得到电子被还原成氢气,方程式如下:

这些方程式很好的阐释了锌片中电化学反应的特征。通过这样一个反应,电子经历了失去和得到两个过程,伴随而来的氧化反应与还原反应则一起发生。
![]()
因此,在电化学中,阳极和阴极反应同时发生并以相同的速率进行。但是,腐蚀现象仅在作为阳极的区域中发生。
丹尼尔电池和电化学腐蚀
1什么是丹尼尔电池
丹尼尔电池就是将Zn(锌)置于ZnSO4(硫酸锌)溶液中,将Cu(铜)置于CuSO4(硫酸铜)溶液中,并用盐桥或离子膜等方法将两种电解质溶液连接的一种原电池。该电池是最早一批具有高敏感性及可靠性的电池,支撑着19世纪许多的工业应用创新,例如电报等。
2丹尼尔电池的原理
丹尼尔电池的原理也属于一种电化学反应,电子从腐蚀的锌片上经过导电途径(例如盐桥等)转移到铜上并形成电流(想进一步了解丹尼尔电池,可以参考一篇介绍Alexander电池的文章,因为该两种电池具有类似的腐蚀机理。
锌片比铜片更加容易失去电子,这也就意味着将锌片和铜片置于其各自的电解质溶液中(硫酸锌和硫酸铜)时,电子能够从外界导电线发生转移,其发生的电化学反应如下图所示:
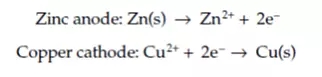
这两种金属之间的腐蚀电位差异通常会导致一种被称为原电池腐蚀(galvanic腐蚀,为了纪念其发现者Luigi Galvani而命名)的情况。
这种情况在自然腐蚀电池中是非常常见的,尤其是当腐蚀电池处于电解质环境中时。液体气氛如土壤,混凝土以及水的传导通常都与金属材料的腐蚀性相关。
下列等式中的描述方程对于每个丹尼尔电池配置都是有效的。该方程将锌电极鉴定为阳极,而铜由于带有正电荷而作为阴极。
![]()
阳极反应和腐蚀
现在我们详细介绍一下发生腐蚀时(阳极反应)在阳极上将发生的情况。例如,铁的腐蚀反应,该反应就涉及到将氢离子还原为氢气这一过程,这与锌在盐酸中的电化学反应一致。
这种析氢反应通常会发生在各种金属和酸性溶液组成的体系中,包括盐酸、硫酸、高氯酸、氢氟酸、甲酸和其他酸等。铁,镍和铝的单独阳极反应如下图所示:

我们可以通过观察上述等式写出腐蚀过程中发生的一般阳极反应:
![]()
也就是说,金属“M”的腐蚀导致金属“M”与价电荷为n+的离子发生化学反应,从而导致“n”电子被释放。n的具体数值当然取决于金属材料本身的性质。一般金属,例如银,是一价的,而多价铁,钛和铀等金属则具有高达+6的正电荷。
该方程式是根据许多情况总结出来的,几乎适用于所有的金属腐蚀反应。
今天的主角团就是以下三位
法拉第定律
阴极反应
表面积影响
法拉第定律和腐蚀电化学
如果由前面提及的阳极反应所产生的电流是已知的,则可以使用Michael Faraday发现的有效关系式将该电流转换成类似的质量损失或腐蚀渗透率。
法拉第的电解实验规律巧妙的将电化学反应中的电流与被反应元素的摩尔数进行了关联。
假设这种反应中每个离子需要得到一个电子,就像电镀银或者银的腐蚀情况一样,可以表示为如下方程式:
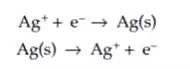
根据法拉第定律,与1摩尔银发生反应将需要1摩尔的电子,或者说是一个阿伏伽德罗的电子数(6.022×1023)。1摩尔电子携带的电荷被定义为一法拉第(F)。1法拉第约等于96485C/(摩尔电子)。
将法拉第的主要参数与特定电化学反应中公认的化学计量学相结合,就可以得出以下等式:
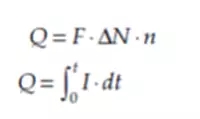
其中,N代表摩尔数,△N代表摩尔数的变化值,n是每分子被反应物质的电子数,I代表总电流(安培,A),t则代表电化学反应的时间(秒,s)。
阴极反应
当氢(H)离子被还原时,正如前面所述,它们通常会与阴极表面的电子反应生成氢气。在阴极表面的这种氢离子的还原可能会干扰酸性氢(H+)离子和形成碱的羟基(OH-)离子之间的平衡,使得该溶液在该区域中酸性较弱,或者呈现出更强的碱性。
在中性水中,一些金属(例如铝、锌和镁等)的阳极腐蚀会产生足够的能量来直接对水进行电离,方程式如下图所示:
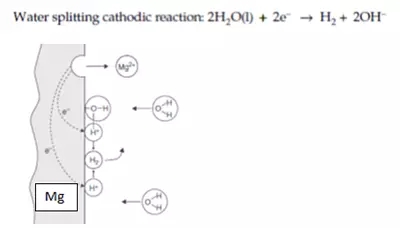
图2:Mg在中性水中发生腐蚀时的电化学反应
氢离子浓度的变化或羟基(OH)离子浓度的增加可以通过测试体系的pH值来衡量,进而明确发生的是哪种阴极反应。在整个腐蚀过程中会发生许多阴极反应,主要包括以下这些:
氧气还原就是其中一种常见的阴极反应,因为氧气存在于大气中以及暴露于环境的溶液中。
此外,虽然金属离子还原和金属沉积现象发生的不是很频繁,但金属离子还原和金属沉积会引起非常严重的腐蚀问题,因此同样需要注意。
所有的腐蚀反应仅仅是一个或多个上述阴极反应与阳极反应的组合。因此,在大多数情况下,无论是单独的还是组合的,每种液体腐蚀的情况都可以归纳成上述那些方程式。
考虑到水或湿空气容易对锌金属造成腐蚀,所以以锌为例,通过将Zn发生腐蚀的氧化反应乘以2并将其与氧还原反应相加,可以得到以下等式:
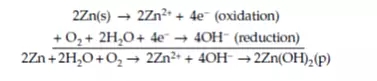
该反应的产物是Zn2+和OH-,这两者会立即发生反应生成不溶的Zn(OH)2。同样地,硫酸铜中的Zn的腐蚀方程式如下列等式所示,简单而言就是Zn的氧化反应与涉及铜(II)离子的金属沉积反应的总和:
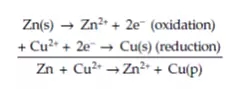
在发生腐蚀反应过程中,有时可能会发生不止一次的氧化和还原反应。
例如在含有溶解氧的浓缩型盐酸溶液中的Zn腐蚀,就可以进行两次阴极反应。一个是氢离子的变化,另一个则是氧的还原反应。
由于存在两种消耗电子的阴极反应,所以锌的一般腐蚀速率将大大增加。因此,这种溶液通常比无空气酸溶液更容易发生腐蚀现象,从酸性溶液中除去氧气通常可以使这些溶液的腐蚀性降低。这也是在许多环境中降低腐蚀性的典型方法。产生的氧气则可以通过化学或一些机械方式排出。
表面积的影响
一块金属材料发生腐蚀时,在阳极区域产生的电子会流过金属在阴极区域发生反应,这些阴极区域暴露在同样的环境中,这些环境有助于维持系统的整体电荷平衡。
在腐蚀表面上没有电荷累积的事实对于理解大多数腐蚀过程和开发出相应减轻腐蚀的方法至关重要。然而,利用以下等式表示的阳极和阴极电流之间的电荷相等却并不意味着这些电流的电流密度也是相等的:
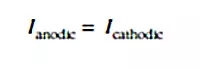
通过获取相对阳极(Sa)和阴极(Sc)的表面积(以及以mA/cm2为单位表示的相关电流密度ia和ic),该方程还可以利用电流密度表示为如下形式:
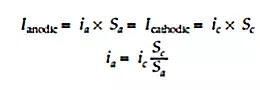
上述方程式中的表面积比(Sc / Sa)对点腐蚀和应力腐蚀开裂等几种局部腐蚀具有重要的参考意义。此外,该值大小对于异种金属的腐蚀发生也有很大的影响。
我们很容易知道,集中在金属表面一小块面积上的阳极电流大小将比在一块更大面积区域上的电流值大得多。当Sc / Sa比值大于1时,这将是一个重要的阳极电流放大相关问题,当该比值小于1时,则是一个不利的因素。
当将两个不同的金属连接(这里是Cu和Fe)时,就可以看到电流密度不等的原因,如图3中所示:
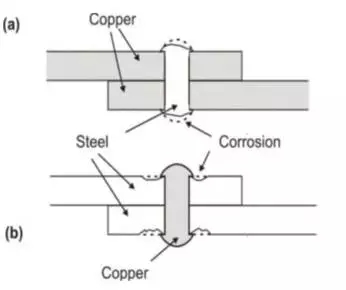
图3
受不同金属影响的区域
“a”表示铜板上的钢铆钉
“b”表示钢板上的铜铆钉
当钢铆钉是铜板上的一部分时,阴极铜板的腐蚀将很小,而小区域阳极钢铆钉的腐蚀程度将很高。另一方面,如果铜铆钉接合钢板,则铜的腐蚀性将会很高,而钢板的腐蚀则不怎么明显。
腐蚀预防
在这篇文章中,我们研究了导致许多材料/结构劣化的电化学腐蚀现象。只有充分了解电化学腐蚀的原因和机理,我们才可以更好的防止腐蚀,因此,腐蚀产品的制造商和使用者应该多加注意腐蚀背后的电化学机制。这将为工业上有效控制腐蚀现象的发生以及制备出具有高度抗腐蚀产品提供巨大的指导意义。
更多关于材料方面、材料腐蚀控制、材料科普等方面的国内外最新动态,我们网站会不断更新。希望大家一直关注中国腐蚀与防护网http://www.ecorr.org
责任编辑:王元
投稿联系:编辑部
电话:010-62313558-806
中国腐蚀与防护网官方 QQ群:140808414
免责声明:本网站所转载的文字、图片与视频资料版权归原创作者所有,如果涉及侵权,请第一时间联系本网删除。

官方微信
《中国腐蚀与防护网电子期刊》征订启事
- 投稿联系:编辑部
- 电话:010-62316606-806
- 邮箱:fsfhzy666@163.com
- 中国腐蚀与防护网官方QQ群:140808414





